よむ、つかう、まなぶ。
資料5-3 外国での新たな措置の報告状況 (41 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
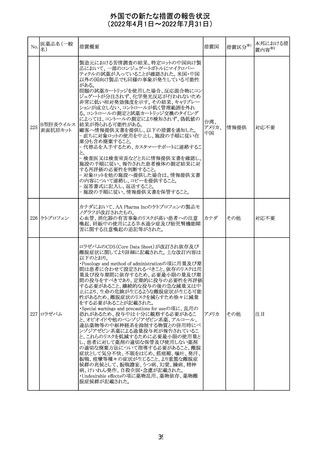
外国での新たな措置の報告状況
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
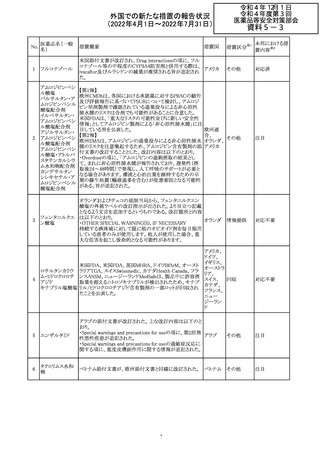
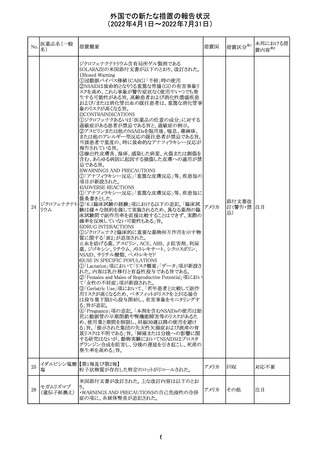
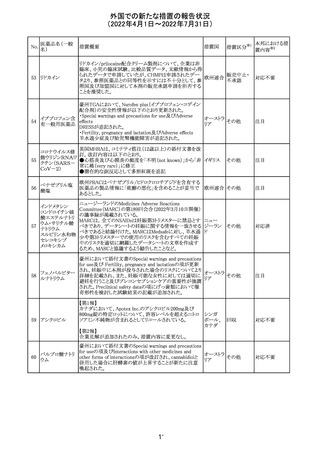
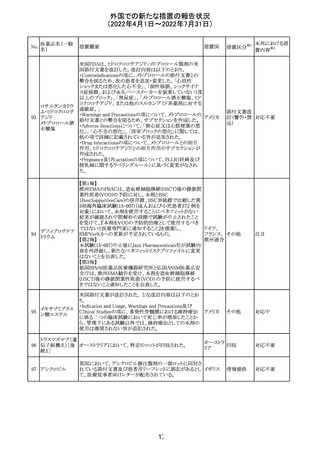
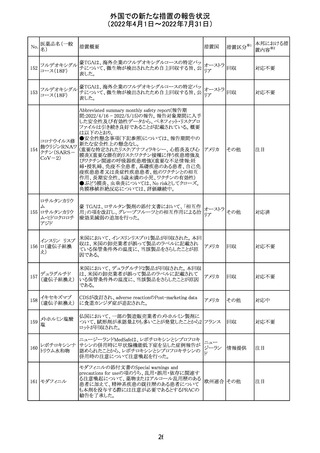
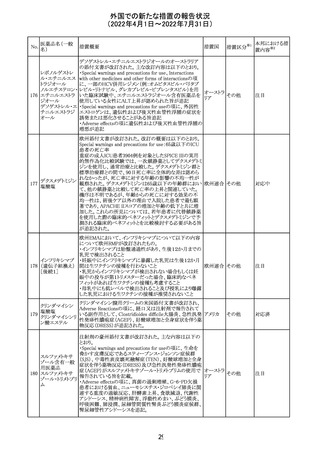
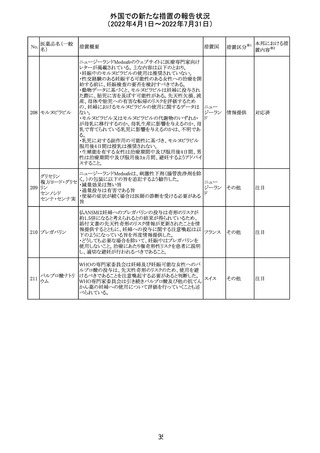
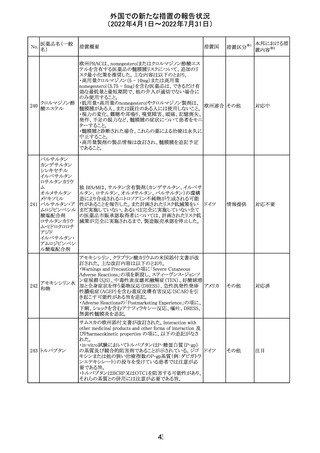
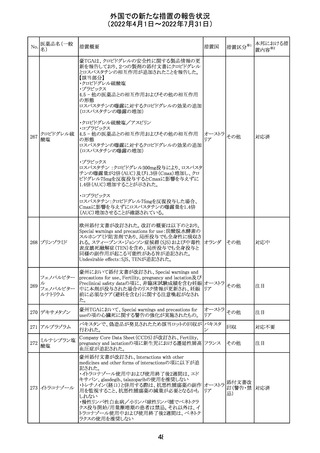
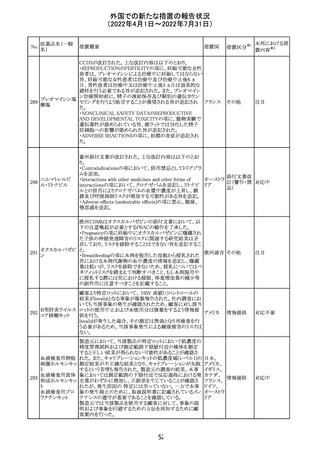
230 ニトログリセリン
231
措置概要
措置国
米国FDA のCDER はニトログリセリンのミスト製剤NitroMist
において、以下のラベリングの改訂を了承した。
1.4.Contraindications(禁忌)の項に 4.5 「循環不全及び
ショック」が追加され、「NitroMist は、急性循環不全やショッ
クのある患者には禁忌」が記載された。
2.「5.Warnings and Precautions(警告と注意事項)」の5.2
「低血圧」の項の「循環血液量が低下している患者、また
は、何らかの理由により既に低血圧になっている患者にお
いては、十分注意して本剤を使用する必要がある。」との記
載が、「循環血液量が低下している患者、または、何らかの
理由により既に低血圧になっている患者においては、症候
性低血圧のリスクが高くなる」との記載へ変更された。
3.「6 Adverse Reactions(副作用)」の項が低血圧、頭痛、
過敏症にまとめられ、ぞれぞれ以下の相互参照がつけられ
た。
・低血圧[(5.2)参照] ・頭痛[(5.4)参照] ・過敏症[(4.4)参
照]
4.「8 Use in Specific Population(特定の集団での使用)」の
項の8.1項の「妊娠」と8.2項の「授乳」の項がリスクカテゴ
リーからPLLR形式に改訂され、以下のリスクサマリーとデー
タが追加された。
アメリカ
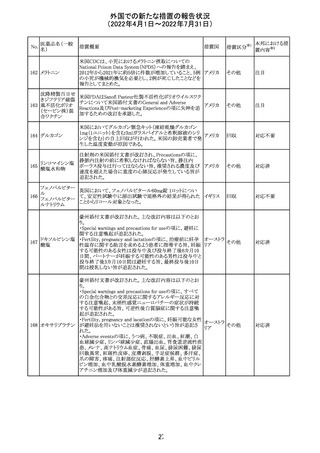
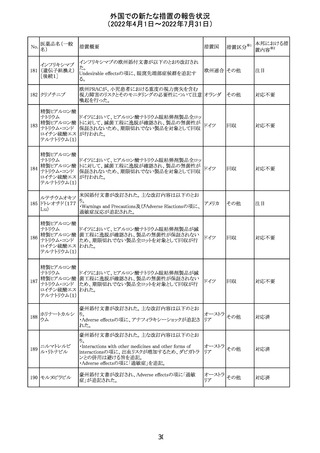
8.1 妊娠 リスクサマリー
ニトログリセリンの使用に関する限られた公表データは、薬
剤に関連する重大な先天性欠損又は自然流産のリスクを
決定するには不十分である。動物生殖試験において、ヒト
用量の64倍を超える用量のニトログリセリンを器官形成期の
ウサギに静脈投与、ラットに腹腔内投与しても有害な発達
異常は認められなかった[データ参照]。
適応となる母集団における重大な先天性欠損及び自然流
産の推定される背景リスクは不明である。米国の一般集団
において推定される背景リスクは、臨床的に認められる妊
娠において重大な先天性欠損で2-4%、自然流産で1520%である。
8.2 授乳 リスクサマリー
ニトログリセリン舌下錠は、授乳中の女性では研究されてい
ない。ニトログリセリンがヒトの母乳に含まれるかどうか、また
ニトログリセリンが乳汁分泌や母乳育児に影響を与えるかど
うかは不明である。したがって、母乳育児の発達と健康上の
利点は、母親のニトログリセリンの必要性、ニトログリセリンま
たは母親の基礎疾患による母乳育児への潜在的な悪影響
とともに考慮されるべきである。
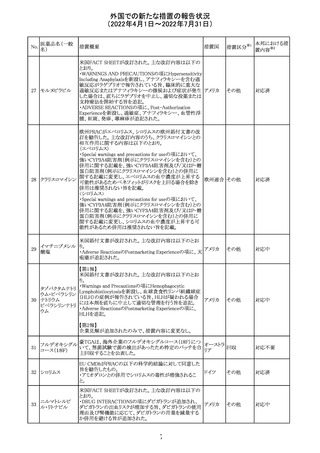
セフトリアキソンナ 仏国において、本剤に同梱されている注射用水アンプルの
フランス
トリウム水和物
シーリング異常のため、特定ロットの回収が行われている。
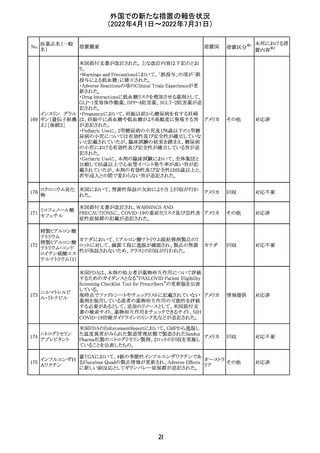
英国において、フェンタニル鼻腔スプレー剤の外装包装
フェンタニルクエ に、癌性疼痛のため他のオピオイドを常用している患者の
232
イギリス
ン酸塩
み使用すること、誤った使用は重篤な危害もしくは致命的と
なる旨が追記された。
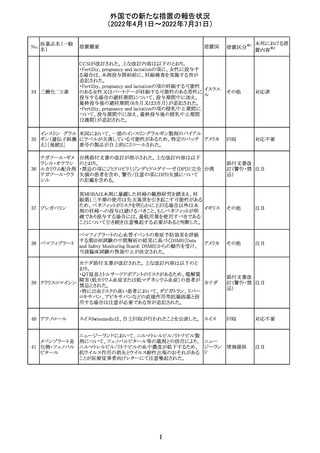
233 テイコプラニン
欧州PRACは、Undesirable effectsの項に汎血球減少症を
追記することを勧告し、CMDhが同意した。
41
措置区分※1
本邦における措
置内容※2
添付文書改
訂(警告・禁 注目
忌)
回収
対応不要
その他
対応済
欧州連合 その他
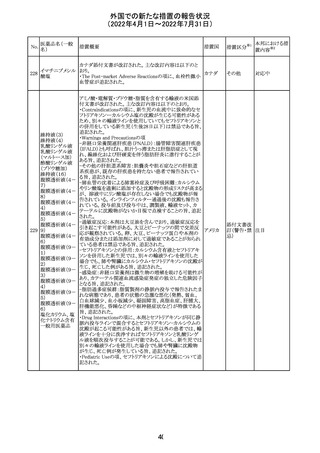
注目
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
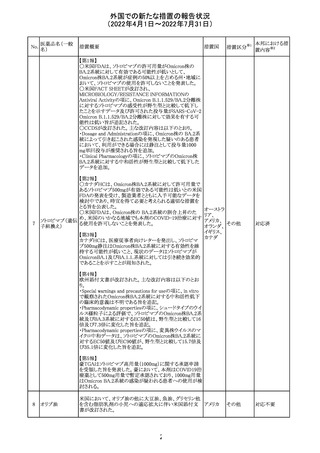
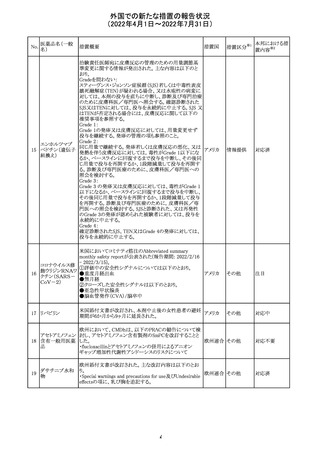
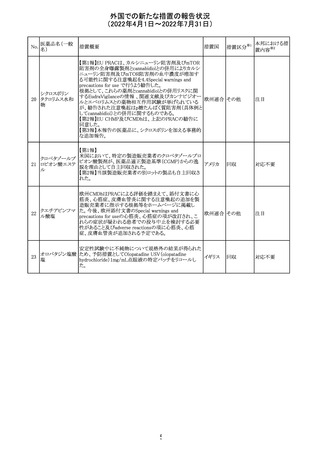
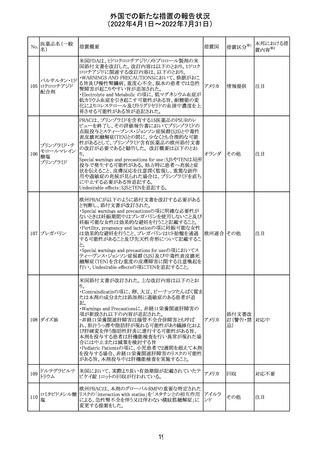
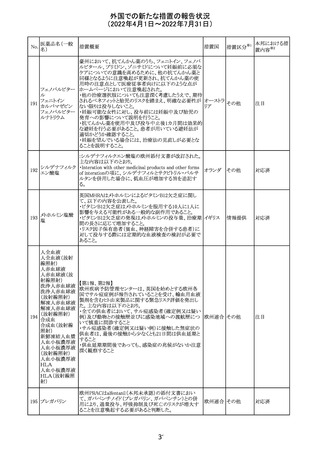
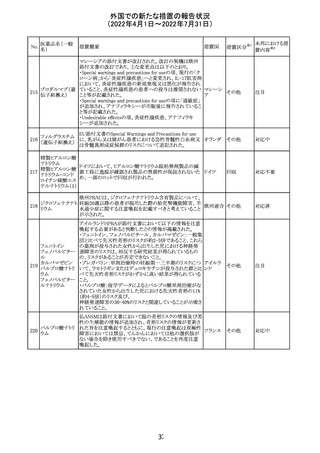
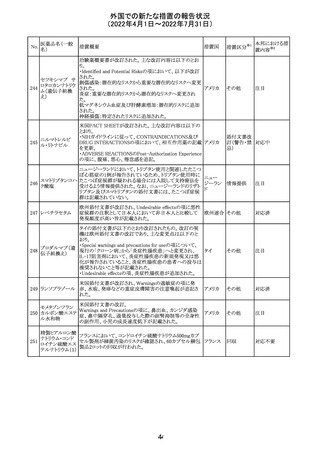
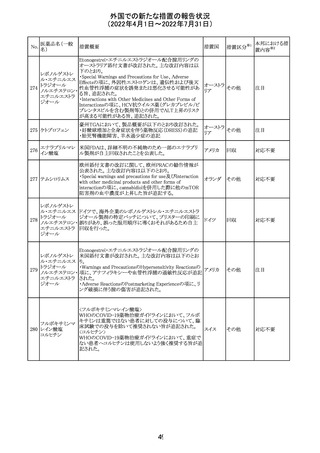
230 ニトログリセリン
231
措置概要
措置国
米国FDA のCDER はニトログリセリンのミスト製剤NitroMist
において、以下のラベリングの改訂を了承した。
1.4.Contraindications(禁忌)の項に 4.5 「循環不全及び
ショック」が追加され、「NitroMist は、急性循環不全やショッ
クのある患者には禁忌」が記載された。
2.「5.Warnings and Precautions(警告と注意事項)」の5.2
「低血圧」の項の「循環血液量が低下している患者、また
は、何らかの理由により既に低血圧になっている患者にお
いては、十分注意して本剤を使用する必要がある。」との記
載が、「循環血液量が低下している患者、または、何らかの
理由により既に低血圧になっている患者においては、症候
性低血圧のリスクが高くなる」との記載へ変更された。
3.「6 Adverse Reactions(副作用)」の項が低血圧、頭痛、
過敏症にまとめられ、ぞれぞれ以下の相互参照がつけられ
た。
・低血圧[(5.2)参照] ・頭痛[(5.4)参照] ・過敏症[(4.4)参
照]
4.「8 Use in Specific Population(特定の集団での使用)」の
項の8.1項の「妊娠」と8.2項の「授乳」の項がリスクカテゴ
リーからPLLR形式に改訂され、以下のリスクサマリーとデー
タが追加された。
アメリカ
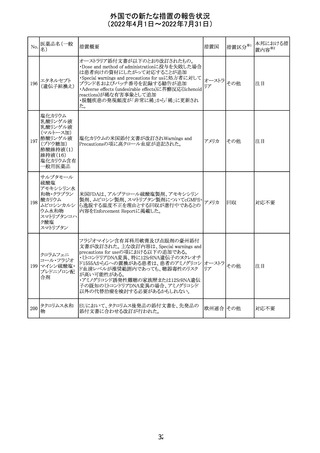
8.1 妊娠 リスクサマリー
ニトログリセリンの使用に関する限られた公表データは、薬
剤に関連する重大な先天性欠損又は自然流産のリスクを
決定するには不十分である。動物生殖試験において、ヒト
用量の64倍を超える用量のニトログリセリンを器官形成期の
ウサギに静脈投与、ラットに腹腔内投与しても有害な発達
異常は認められなかった[データ参照]。
適応となる母集団における重大な先天性欠損及び自然流
産の推定される背景リスクは不明である。米国の一般集団
において推定される背景リスクは、臨床的に認められる妊
娠において重大な先天性欠損で2-4%、自然流産で1520%である。
8.2 授乳 リスクサマリー
ニトログリセリン舌下錠は、授乳中の女性では研究されてい
ない。ニトログリセリンがヒトの母乳に含まれるかどうか、また
ニトログリセリンが乳汁分泌や母乳育児に影響を与えるかど
うかは不明である。したがって、母乳育児の発達と健康上の
利点は、母親のニトログリセリンの必要性、ニトログリセリンま
たは母親の基礎疾患による母乳育児への潜在的な悪影響
とともに考慮されるべきである。
セフトリアキソンナ 仏国において、本剤に同梱されている注射用水アンプルの
フランス
トリウム水和物
シーリング異常のため、特定ロットの回収が行われている。
英国において、フェンタニル鼻腔スプレー剤の外装包装
フェンタニルクエ に、癌性疼痛のため他のオピオイドを常用している患者の
232
イギリス
ン酸塩
み使用すること、誤った使用は重篤な危害もしくは致命的と
なる旨が追記された。
233 テイコプラニン
欧州PRACは、Undesirable effectsの項に汎血球減少症を
追記することを勧告し、CMDhが同意した。
41
措置区分※1
本邦における措
置内容※2
添付文書改
訂(警告・禁 注目
忌)
回収
対応不要
その他
対応済
欧州連合 その他
注目