よむ、つかう、まなぶ。
資料5-3 外国での新たな措置の報告状況 (52 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
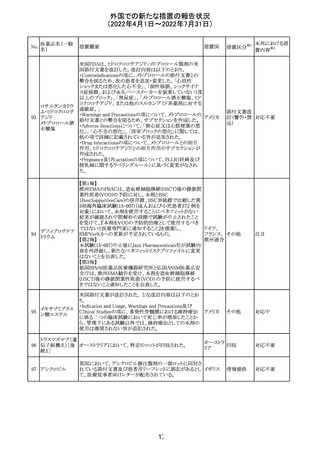
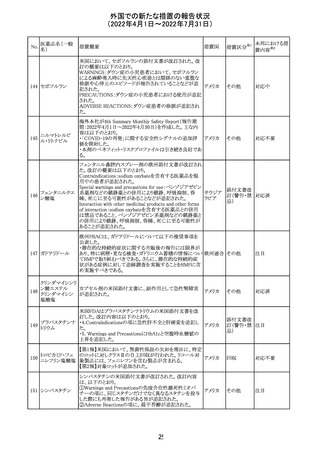
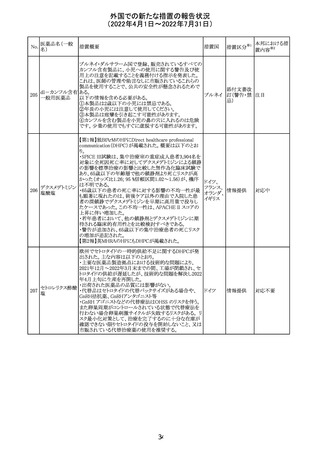
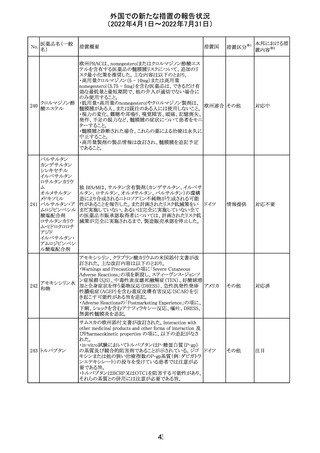
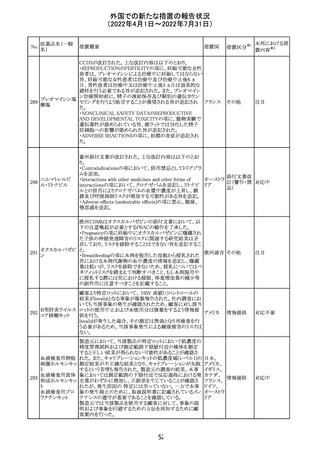
外国での新たな措置の報告状況
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
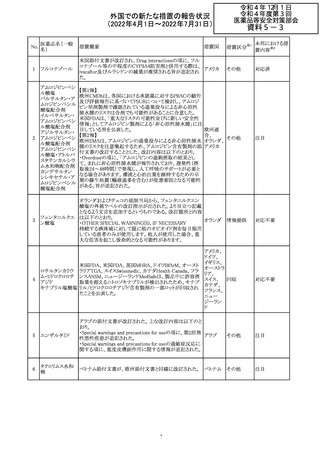
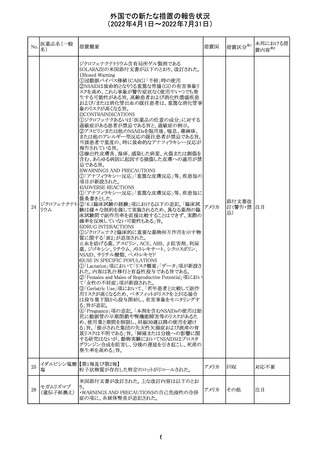
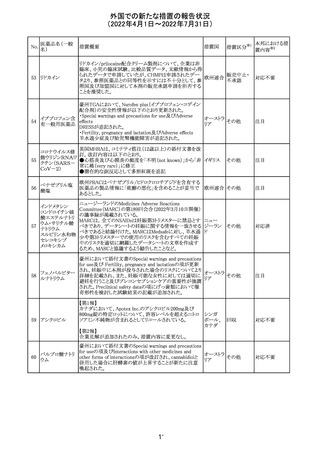
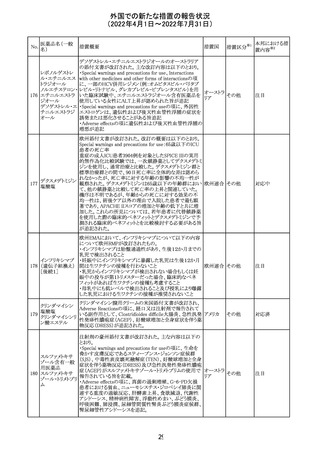
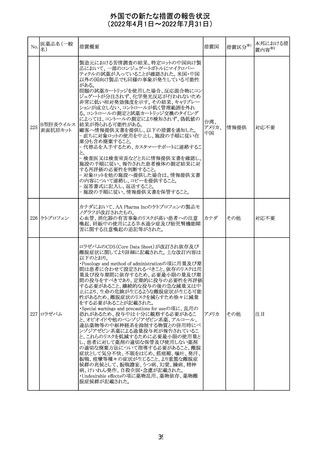
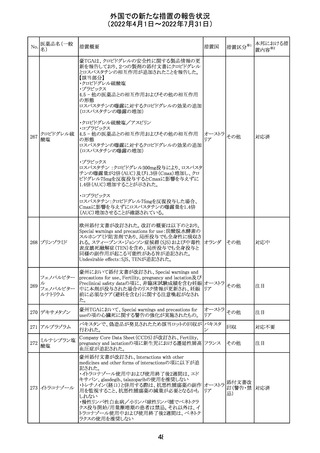
CCDSが改訂された。主な改訂内容は以下のとおり。
・REPRODUCTIONのFERTILITYの項に、妊娠可能な女性
患者は、ブレオマイシンによる治療中に妊娠してはならない
旨、妊娠可能な女性患者は治療中及び治療中止後6 ヵ
月、男性患者は治療中又は治療中止後3 ヵ月は効果的な
避妊を行う必要である旨が追記された。また、ブレオマイシ
ン治療開始前に、精子の凍結保存及び個別の遺伝カウン
ブレオマイシン塩
289
セリングを行うよう助言することが推奨される旨が追記され フランス
酸塩
た。
・NONCLINICAL SAFETY DATAのREPRODUCTIVE
AND DEVELOPMENTAL TOXICITYの項に、動物実験で
遺伝毒性が認められている旨、雄ラットでは分化した精子
原細胞への影響が認められた旨が追記された。
・ADVERSE REACTIONSの項に、粘膜の炎症が追記され
た。
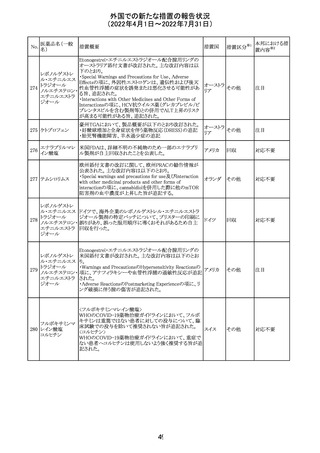
290
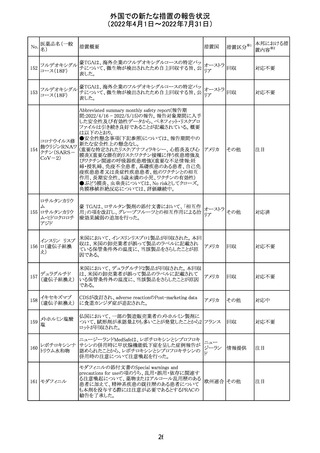
ニルマトレルビ
ル・リトナビル
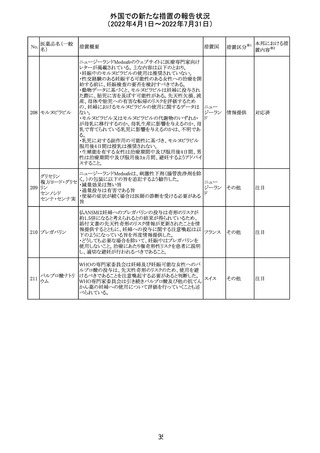
措置区分※1
本邦における措
置内容※2
その他
注目
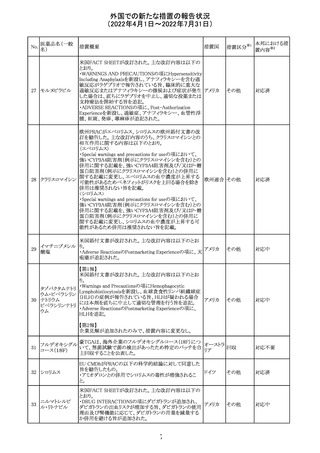
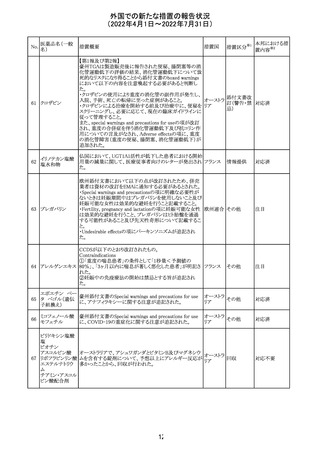
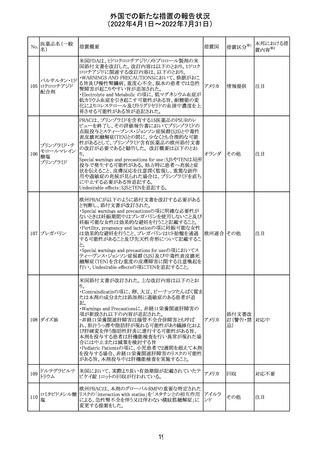
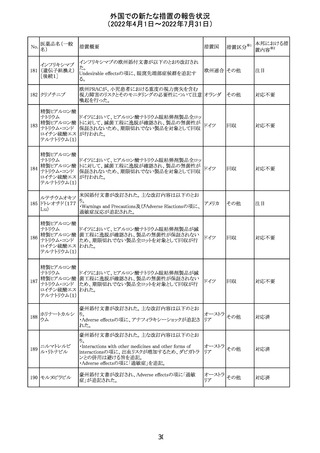
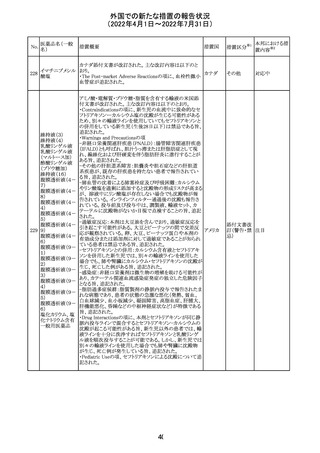
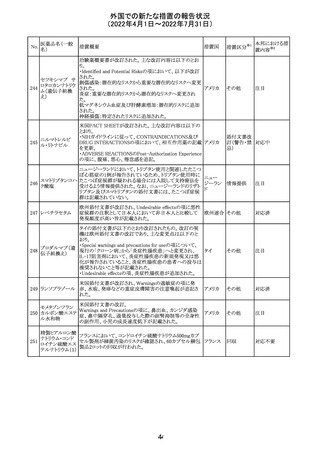
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Contraindicationsの項において、併用禁忌としてトリアゾラ
ムを追加。
添付文書改
・Interactions with other medicines and other forms of
オーストラ
訂(警告・禁 対応中
interactionsの項において、クロナゼパムを追記し、リトナビ リア
忌)
ルとの併用によりクロナゼパムの血漿中濃度が上昇し、鎮
静及び呼吸抑制リスクが増加する可能性がある旨を追記。
・Adverse effects (undesirable effects)の項に悪心、腹痛、
倦怠感を追記。
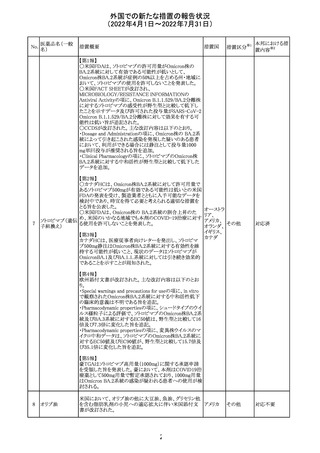
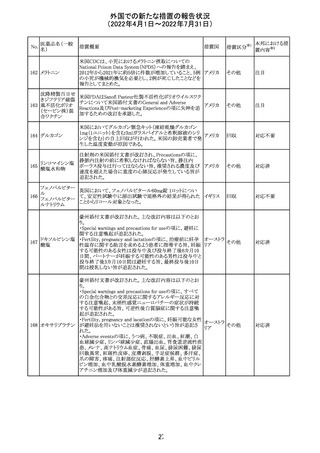
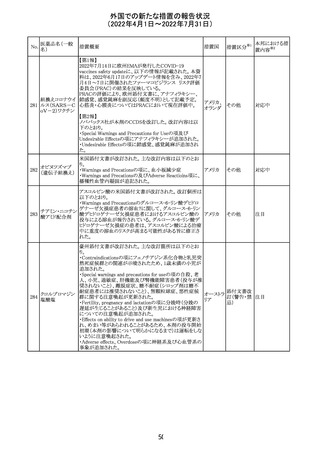
欧州CDMhはオクスカルバゼピンの添付文書において、以
下の注意喚起が必要とするPRACの勧告を了承した。
・Pregnancyの項に妊娠中にオクスカルバゼピンに曝露され
た子供の神経発達障害のリスクに関連する研究結果は矛
盾しており、リスクを排除することはできない旨を追記するこ
オクスカルバゼピ と。
291
欧州連合 その他
ン
・Breastfeedingの項に本剤を服用した母親から授乳された
児における本剤代謝物の血中濃度の情報を追記し、曝露
量は低いが、リスクを排除できないため、授乳についてはベ
ネフィットリスクを踏まえて判断すべきこと、もし本剤服用中
に授乳する際には児における傾眠、体重増加量の減少等
の副作用に注意すべきことを記載すること。
注目
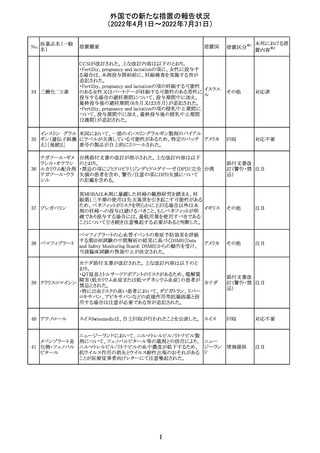
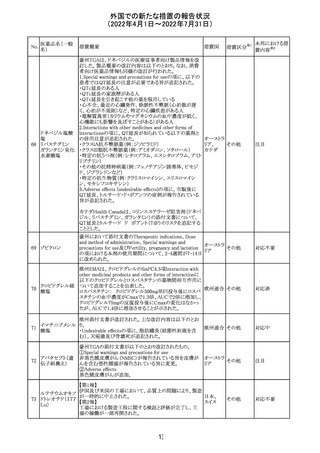
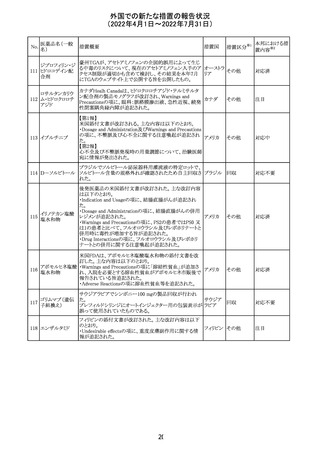
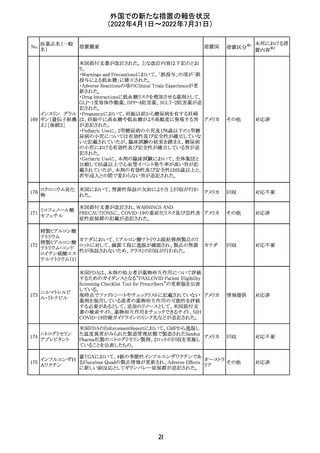
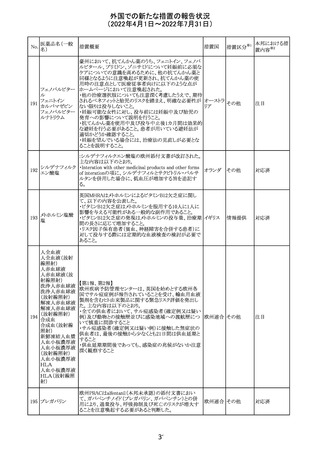
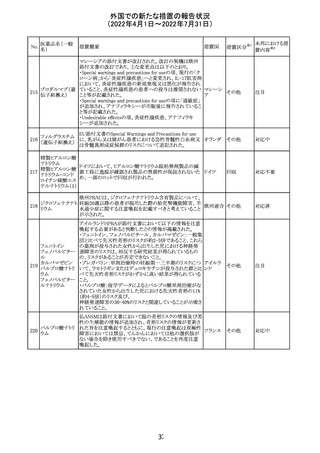
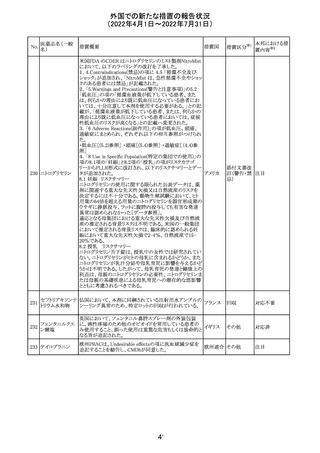
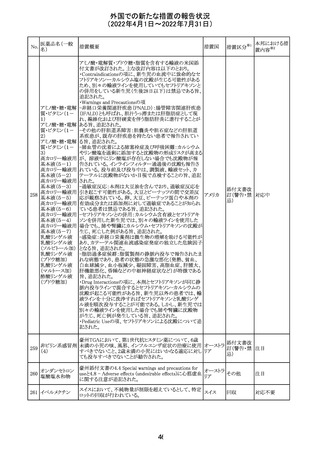
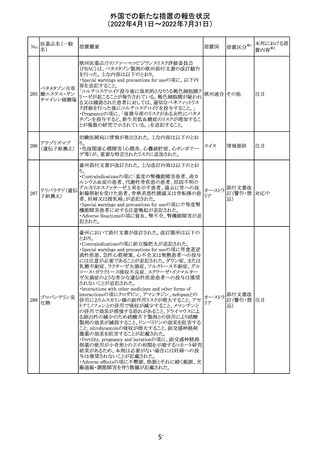
顧客より特定ロットにおいて、 HBV 高値(+)コントロールの
結果がInvalidとなる事象が複数報告された。社内調査にお
いても当該事象の発生が確認されたため、顧客に対し該当
B型肝炎ウイルス ロットの使用中止および未使用分は廃棄をするよう情報提
292
アメリカ
コア核酸キット
供を行う。
Invalidが発生した場合、その測定は無効となり再検査を行
う必要があるため、当該事象発生による健康被害のリスクは
ない。
対応不要
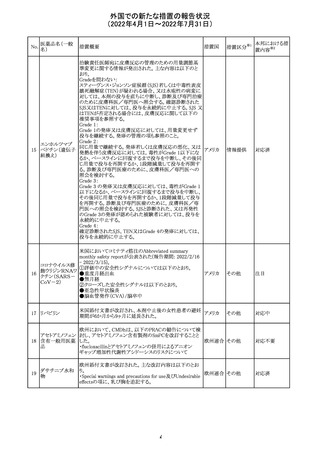
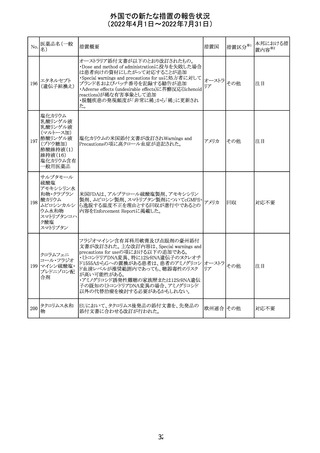
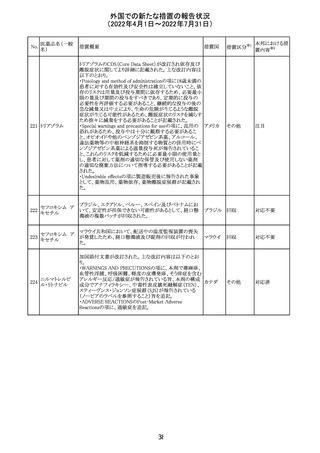
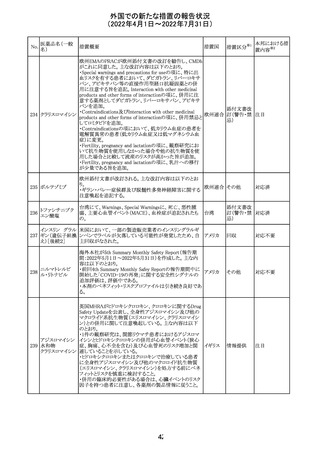
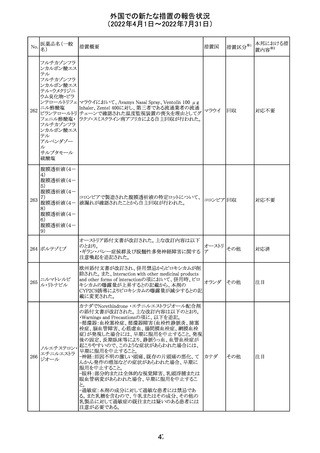
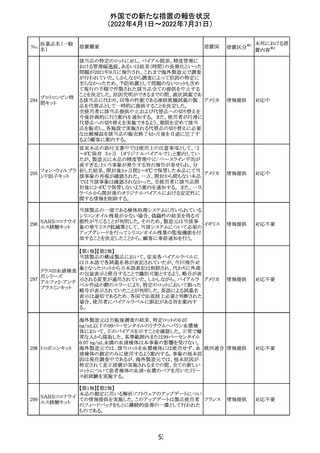
血液検査用卵胞
刺激ホルモンキッ
ト
血液検査用黄体
293
形成ホルモンキッ
ト
血液検査用プロ
ラクチンキット
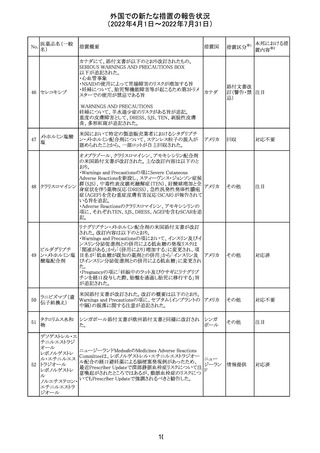
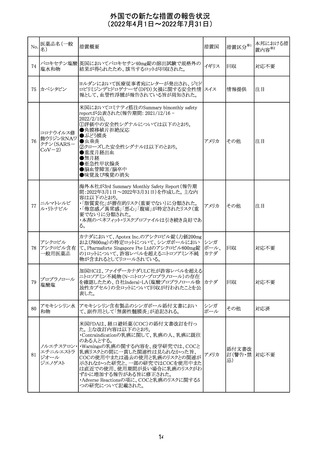
製造元において、当該製品の特定ロットにおいて低濃度の
精度管理試料および測定範囲下限値付近の検体を測定
すると正しい結果が得られない可能性があることが確認さ
れた。また、キャリブレーションキットの低濃度域(レベル1)の
測定結果が不正確な結果となり、キャリブレーションが失敗
するという苦情も報告された。製造元の調査の結果、本事
象においては測定範囲の下限付近で反応過程における発
光量がわずかに増加し、正誤差を生じていることが確認さ
れたが、発生原因の 特定には至っていない。一方で本事
象の発生抑止のために、取扱説明書に記載されているメン
テナンスの遵守が重要であることを確認している。
製造元では当該製品を使用する顧客に対して、事象の説
明および事象を回避するための方法を周知するために顧
客案内を行った。
52
情報提供
日本、
アメリカ、
イギリス、
カナダ、
情報提供
フランス、
ドイツ、
オーストラ
リア
対応中
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
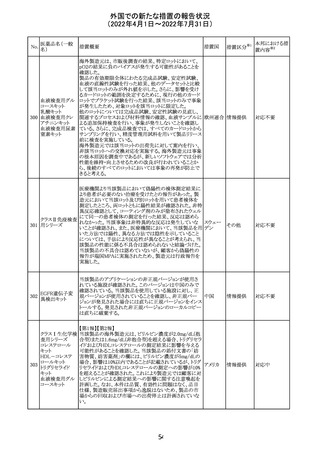
CCDSが改訂された。主な改訂内容は以下のとおり。
・REPRODUCTIONのFERTILITYの項に、妊娠可能な女性
患者は、ブレオマイシンによる治療中に妊娠してはならない
旨、妊娠可能な女性患者は治療中及び治療中止後6 ヵ
月、男性患者は治療中又は治療中止後3 ヵ月は効果的な
避妊を行う必要である旨が追記された。また、ブレオマイシ
ン治療開始前に、精子の凍結保存及び個別の遺伝カウン
ブレオマイシン塩
289
セリングを行うよう助言することが推奨される旨が追記され フランス
酸塩
た。
・NONCLINICAL SAFETY DATAのREPRODUCTIVE
AND DEVELOPMENTAL TOXICITYの項に、動物実験で
遺伝毒性が認められている旨、雄ラットでは分化した精子
原細胞への影響が認められた旨が追記された。
・ADVERSE REACTIONSの項に、粘膜の炎症が追記され
た。
290
ニルマトレルビ
ル・リトナビル
措置区分※1
本邦における措
置内容※2
その他
注目
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Contraindicationsの項において、併用禁忌としてトリアゾラ
ムを追加。
添付文書改
・Interactions with other medicines and other forms of
オーストラ
訂(警告・禁 対応中
interactionsの項において、クロナゼパムを追記し、リトナビ リア
忌)
ルとの併用によりクロナゼパムの血漿中濃度が上昇し、鎮
静及び呼吸抑制リスクが増加する可能性がある旨を追記。
・Adverse effects (undesirable effects)の項に悪心、腹痛、
倦怠感を追記。
欧州CDMhはオクスカルバゼピンの添付文書において、以
下の注意喚起が必要とするPRACの勧告を了承した。
・Pregnancyの項に妊娠中にオクスカルバゼピンに曝露され
た子供の神経発達障害のリスクに関連する研究結果は矛
盾しており、リスクを排除することはできない旨を追記するこ
オクスカルバゼピ と。
291
欧州連合 その他
ン
・Breastfeedingの項に本剤を服用した母親から授乳された
児における本剤代謝物の血中濃度の情報を追記し、曝露
量は低いが、リスクを排除できないため、授乳についてはベ
ネフィットリスクを踏まえて判断すべきこと、もし本剤服用中
に授乳する際には児における傾眠、体重増加量の減少等
の副作用に注意すべきことを記載すること。
注目
顧客より特定ロットにおいて、 HBV 高値(+)コントロールの
結果がInvalidとなる事象が複数報告された。社内調査にお
いても当該事象の発生が確認されたため、顧客に対し該当
B型肝炎ウイルス ロットの使用中止および未使用分は廃棄をするよう情報提
292
アメリカ
コア核酸キット
供を行う。
Invalidが発生した場合、その測定は無効となり再検査を行
う必要があるため、当該事象発生による健康被害のリスクは
ない。
対応不要
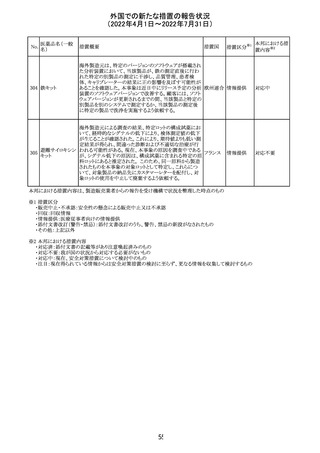
血液検査用卵胞
刺激ホルモンキッ
ト
血液検査用黄体
293
形成ホルモンキッ
ト
血液検査用プロ
ラクチンキット
製造元において、当該製品の特定ロットにおいて低濃度の
精度管理試料および測定範囲下限値付近の検体を測定
すると正しい結果が得られない可能性があることが確認さ
れた。また、キャリブレーションキットの低濃度域(レベル1)の
測定結果が不正確な結果となり、キャリブレーションが失敗
するという苦情も報告された。製造元の調査の結果、本事
象においては測定範囲の下限付近で反応過程における発
光量がわずかに増加し、正誤差を生じていることが確認さ
れたが、発生原因の 特定には至っていない。一方で本事
象の発生抑止のために、取扱説明書に記載されているメン
テナンスの遵守が重要であることを確認している。
製造元では当該製品を使用する顧客に対して、事象の説
明および事象を回避するための方法を周知するために顧
客案内を行った。
52
情報提供
日本、
アメリカ、
イギリス、
カナダ、
情報提供
フランス、
ドイツ、
オーストラ
リア
対応中