よむ、つかう、まなぶ。
資料5-3 外国での新たな措置の報告状況 (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
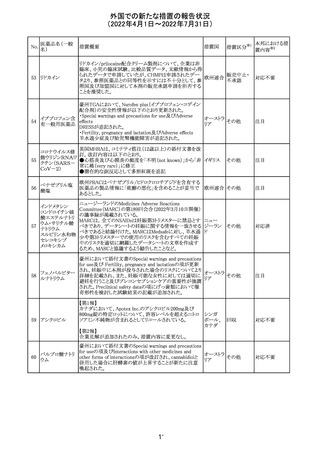
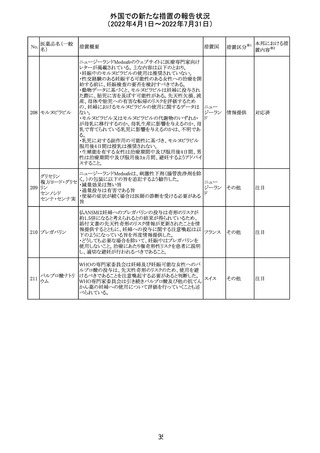
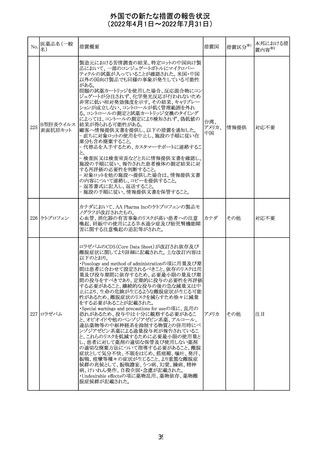
外国での新たな措置の報告状況
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
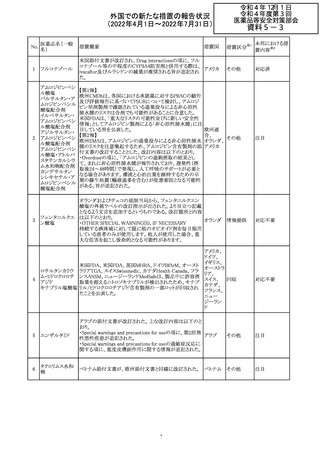
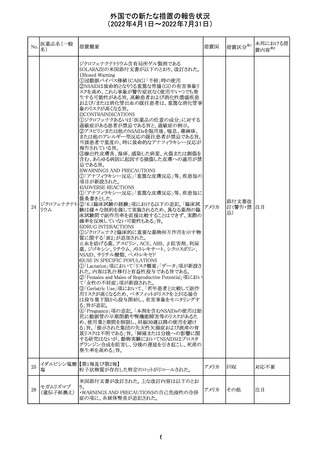
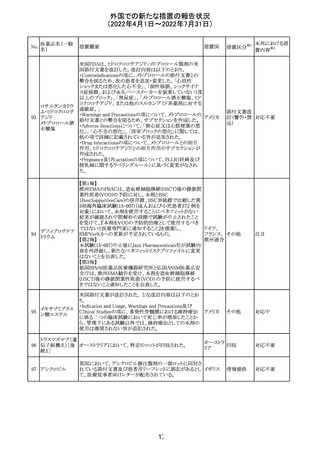
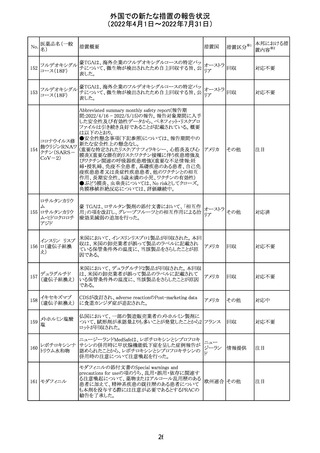
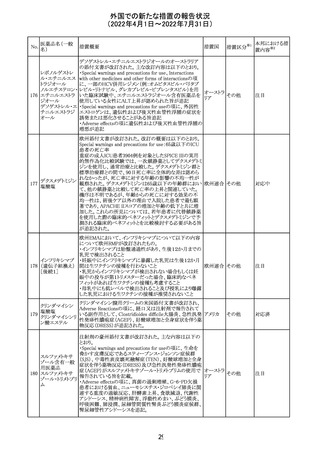
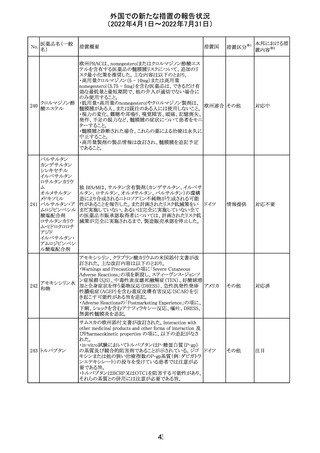
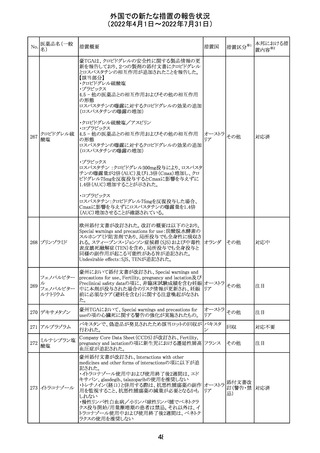
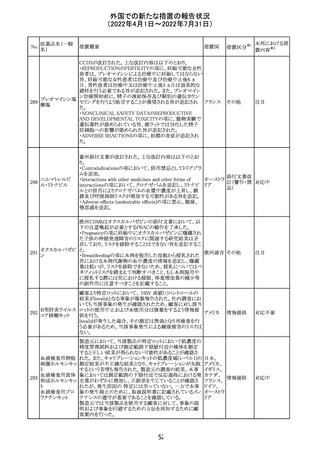
228
カナダ添付文書が改訂された。主な改訂内容は以下のと
イマチニブメシル おり。
カナダ
酸塩
・The Post-market Adverse Reactionsの項に、血栓性微小
血管症が追記された。
維持液(3)
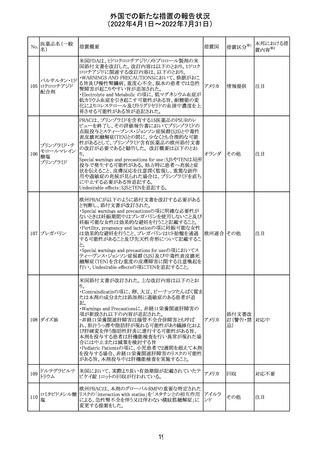
維持液(4)
乳酸リンゲル液
乳酸リンゲル液
(マルトース加)
酢酸リンゲル液
(ブドウ糖加)
維持液(16)
腹膜透析液(4-
7)
腹膜透析液(4-
8)
腹膜透析液(4-
4)
腹膜透析液(4-
5)
腹膜透析液(4-
229 9)
腹膜透析液(4-
6)
腹膜透析液(9-
1)
腹膜透析液(9-
2)
腹膜透析液(9-
3)
腹膜透析液(9-
4)
腹膜透析液(9-
5)
腹膜透析液(9-
6)
塩化カリウム、塩
化ナトリウム含有
一般用医薬品
措置概要
措置国
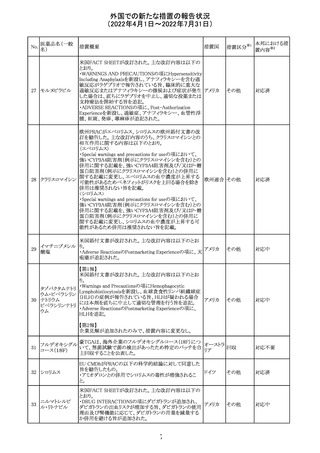
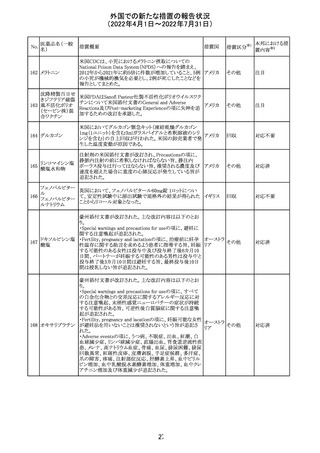
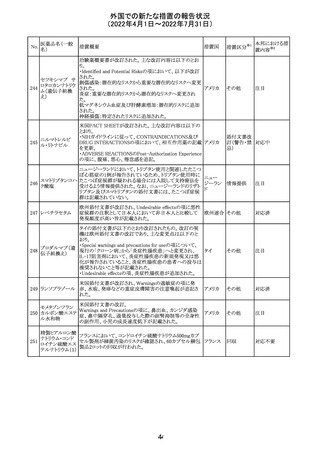
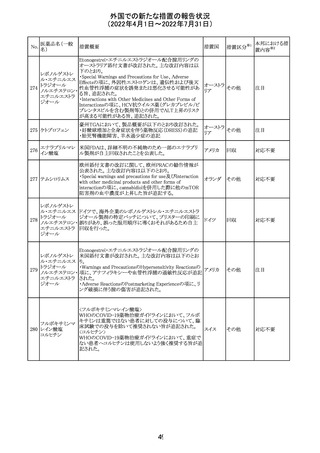
アミノ酸・電解質・ブドウ糖・脂質を含有する輸液の米国添
付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に、新生児の血流中に致命的なセ
フトリアキソンーカルシウム塩の沈殿が生じる可能性がある
ため、別々の輸液ラインを使用していてもセフトリアキソンと
の併用をしている新生児(生後28日以下)は禁忌である旨、
追記された。
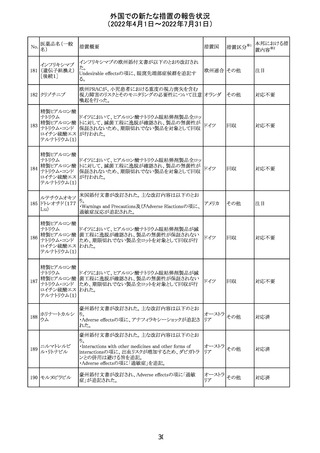
・Warnings and Precautionsの項
-非経口栄養関連肝疾患(PNALD):腸管障害関連肝疾患
(IFALD)とも呼ばれ、胆汁うっ滞または肝脂肪症として現
れ、線維化および肝硬変を伴う脂肪肝炎に進行することが
ある旨、追記された。
-その他の肝胆道系障害:胆嚢炎や胆石症などの肝胆道
系疾患が、既存の肝疾患を持たない患者で報告されてい
る旨、追記された。
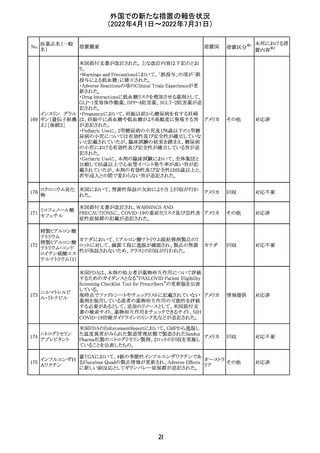
-肺血管の沈着による肺塞栓症及び呼吸困難:カルシウム
やリン酸塩を過剰に添加すると沈殿物の形成リスクが高まる
が、 溶液中にリン酸塩が存在しない場合でも沈殿物が報
告されている。インラインフィルター通過後の沈殿も報告さ
れている。投与前及び投与中は、調製液、輸液セット、カ
テーテルに沈殿物がないか目視で点検することの旨、追記
された。
-過敏症反応:本剤は大豆油を含んでおり、過敏症反応を
引き起こす可能性がある。大豆とピーナッツの間で交差反
アメリカ
応が観察されている。卵、大豆、ピーナッツ蛋白や本剤の
有効成分または添加剤に対して過敏症であることが知られ
ている患者は禁忌である旨、追記された。
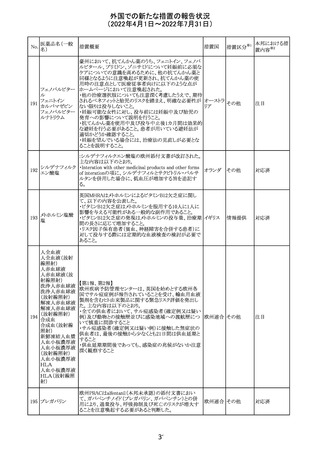
-セフトリアキソンとの併用:カルシウム含有液とセフトリアキ
ソンを併用した新生児では、別々の輸液ラインを使用した
場合でも、肺や腎臓にカルシウム・セフトリアキソンの沈殿が
生じ、死亡した例がある旨、追記された。
-感染症:非経口栄養剤は微生物の増殖を助ける可能性が
あり、カテーテル関連血流感染症発症の独立した危険因子
となる旨、追記された。
-脂肪過多症候群:脂質製剤の静脈内投与で報告されたま
れな病態であり、患者の状態の急激な悪化(発熱、貧血、
白血球減少、血小板減少、凝固障害、高脂血症、肝腫大、
肝機能悪化、昏睡などの中枢神経症状など)が特徴である
旨、追記された。
・Drug Interactionsの項に、本剤とセフトリアキソンが同じ静
脈内投与ラインで混合するとセフトリアキソン-カルシウムの
沈殿が起こる可能性がある旨、新生児以外の患者では、輸
液ラインを十分に洗浄すればセフトリアキソンと乳酸リンゲ
ル液を順次投与することが可能である。しかし、新生児では
別々の輸液ラインを使用した場合でも肺や腎臓に沈殿物
が生じ、死亡例が発生している旨、追記された。
・Pediatric Useの項、セフトリアキソンによる沈殿について追
記された。
40
措置区分※1
本邦における措
置内容※2
その他
対応中
添付文書改
訂(警告・禁 注目
忌)
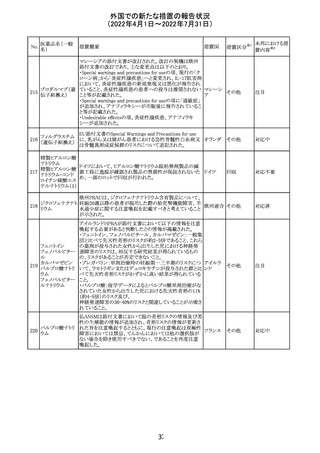
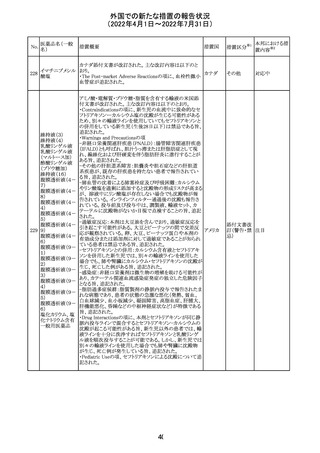
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
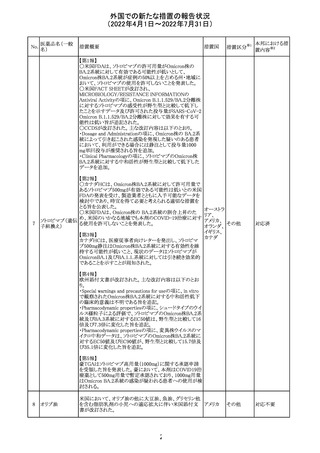
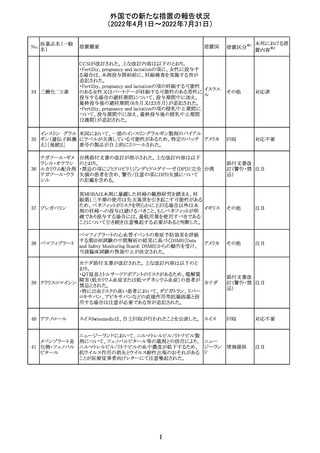
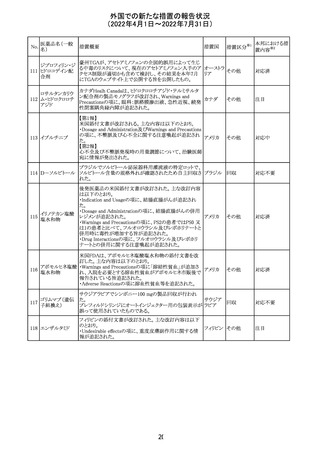
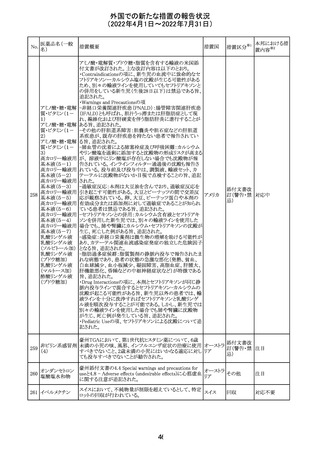
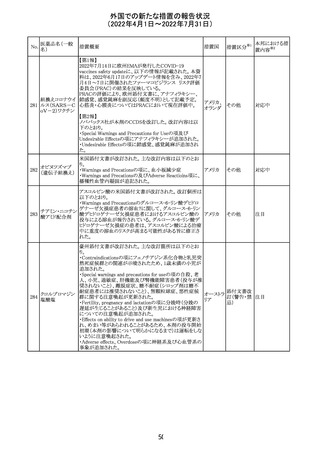
228
カナダ添付文書が改訂された。主な改訂内容は以下のと
イマチニブメシル おり。
カナダ
酸塩
・The Post-market Adverse Reactionsの項に、血栓性微小
血管症が追記された。
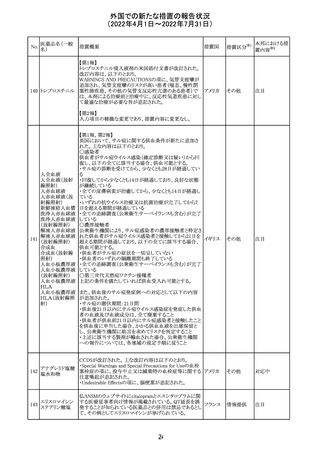
維持液(3)
維持液(4)
乳酸リンゲル液
乳酸リンゲル液
(マルトース加)
酢酸リンゲル液
(ブドウ糖加)
維持液(16)
腹膜透析液(4-
7)
腹膜透析液(4-
8)
腹膜透析液(4-
4)
腹膜透析液(4-
5)
腹膜透析液(4-
229 9)
腹膜透析液(4-
6)
腹膜透析液(9-
1)
腹膜透析液(9-
2)
腹膜透析液(9-
3)
腹膜透析液(9-
4)
腹膜透析液(9-
5)
腹膜透析液(9-
6)
塩化カリウム、塩
化ナトリウム含有
一般用医薬品
措置概要
措置国
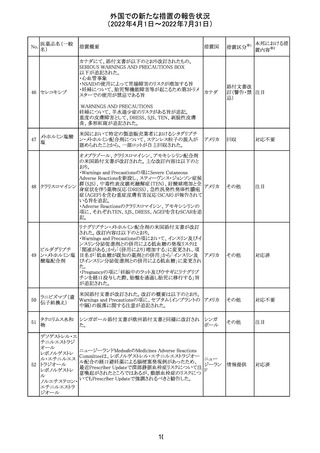
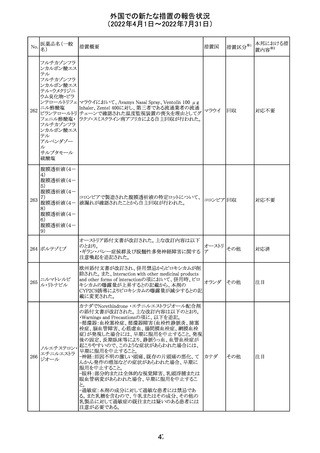
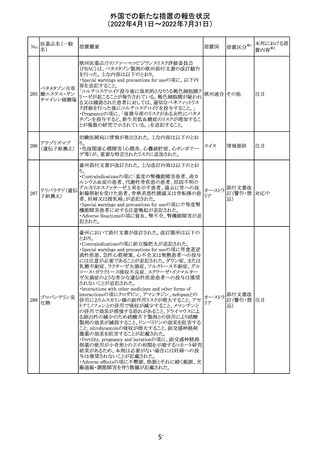
アミノ酸・電解質・ブドウ糖・脂質を含有する輸液の米国添
付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に、新生児の血流中に致命的なセ
フトリアキソンーカルシウム塩の沈殿が生じる可能性がある
ため、別々の輸液ラインを使用していてもセフトリアキソンと
の併用をしている新生児(生後28日以下)は禁忌である旨、
追記された。
・Warnings and Precautionsの項
-非経口栄養関連肝疾患(PNALD):腸管障害関連肝疾患
(IFALD)とも呼ばれ、胆汁うっ滞または肝脂肪症として現
れ、線維化および肝硬変を伴う脂肪肝炎に進行することが
ある旨、追記された。
-その他の肝胆道系障害:胆嚢炎や胆石症などの肝胆道
系疾患が、既存の肝疾患を持たない患者で報告されてい
る旨、追記された。
-肺血管の沈着による肺塞栓症及び呼吸困難:カルシウム
やリン酸塩を過剰に添加すると沈殿物の形成リスクが高まる
が、 溶液中にリン酸塩が存在しない場合でも沈殿物が報
告されている。インラインフィルター通過後の沈殿も報告さ
れている。投与前及び投与中は、調製液、輸液セット、カ
テーテルに沈殿物がないか目視で点検することの旨、追記
された。
-過敏症反応:本剤は大豆油を含んでおり、過敏症反応を
引き起こす可能性がある。大豆とピーナッツの間で交差反
アメリカ
応が観察されている。卵、大豆、ピーナッツ蛋白や本剤の
有効成分または添加剤に対して過敏症であることが知られ
ている患者は禁忌である旨、追記された。
-セフトリアキソンとの併用:カルシウム含有液とセフトリアキ
ソンを併用した新生児では、別々の輸液ラインを使用した
場合でも、肺や腎臓にカルシウム・セフトリアキソンの沈殿が
生じ、死亡した例がある旨、追記された。
-感染症:非経口栄養剤は微生物の増殖を助ける可能性が
あり、カテーテル関連血流感染症発症の独立した危険因子
となる旨、追記された。
-脂肪過多症候群:脂質製剤の静脈内投与で報告されたま
れな病態であり、患者の状態の急激な悪化(発熱、貧血、
白血球減少、血小板減少、凝固障害、高脂血症、肝腫大、
肝機能悪化、昏睡などの中枢神経症状など)が特徴である
旨、追記された。
・Drug Interactionsの項に、本剤とセフトリアキソンが同じ静
脈内投与ラインで混合するとセフトリアキソン-カルシウムの
沈殿が起こる可能性がある旨、新生児以外の患者では、輸
液ラインを十分に洗浄すればセフトリアキソンと乳酸リンゲ
ル液を順次投与することが可能である。しかし、新生児では
別々の輸液ラインを使用した場合でも肺や腎臓に沈殿物
が生じ、死亡例が発生している旨、追記された。
・Pediatric Useの項、セフトリアキソンによる沈殿について追
記された。
40
措置区分※1
本邦における措
置内容※2
その他
対応中
添付文書改
訂(警告・禁 注目
忌)