よむ、つかう、まなぶ。
資料5-3 外国での新たな措置の報告状況 (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
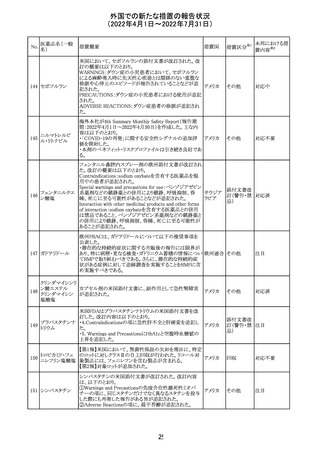
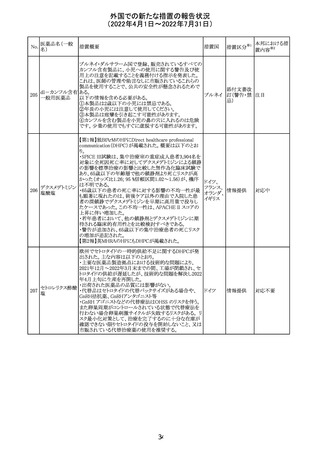
外国での新たな措置の報告状況
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
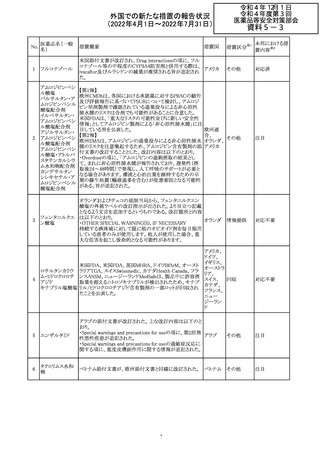
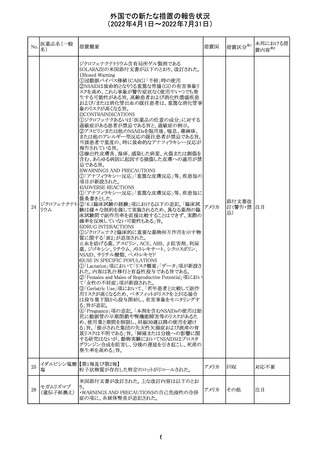
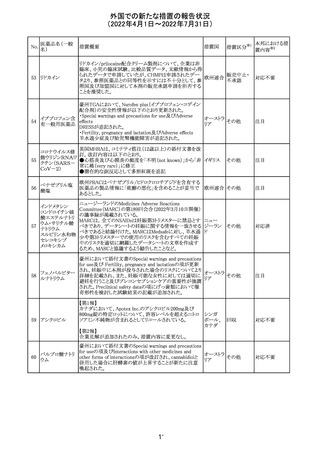
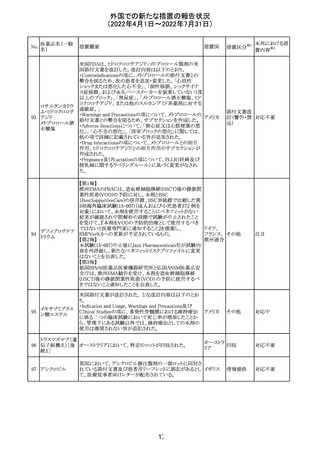
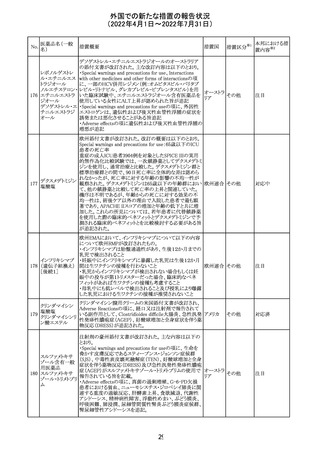
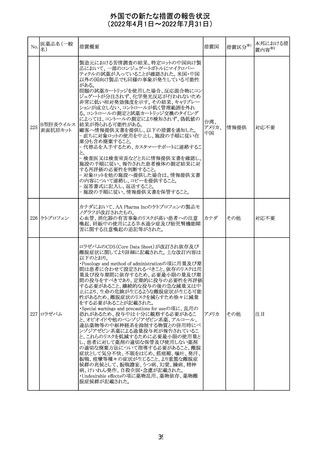
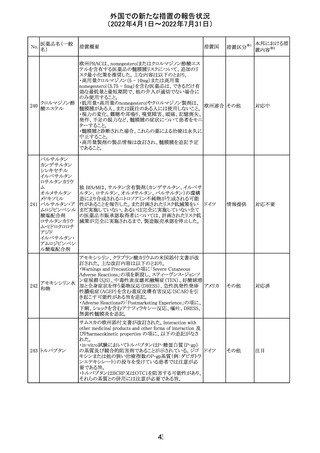
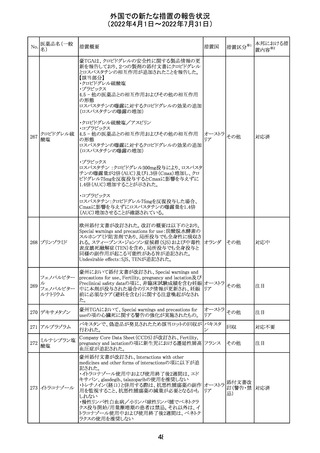
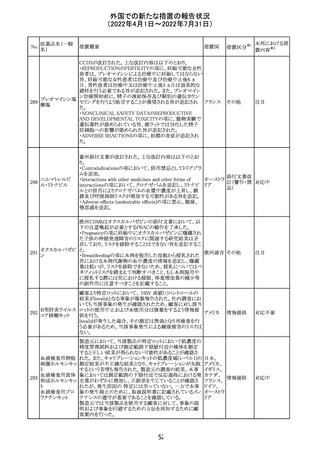
欧州PRACは、nomegesterolまたはクロルマジノン酢酸エス
テルを含有する医薬品の髄膜腫リスクについて、追加のリ
スク最小化策を推奨した。主な内容は以下のとおり。
・高用量クロルマジノン(5 - 10mg)または高用量
nomegesterol(3.75 - 5mg)を含む医薬品は、できるだけ有
効な最低量と最短期間で、他の介入が適切でない場合に
のみ使用すること。
クロルマジノン酢 ・低用量・高用量のnomegesterolやクロルマジノン製剤は、
240
欧州連合 その他
酸エステル
髄膜腫がある人、または既往のある人には使用しないこと。
・視力の変化、難聴や耳鳴り、嗅覚障害、頭痛、記憶喪失、
発作、手足の脱力など、髄膜腫の症状について患者をモニ
ターすること。
・髄膜腫と診断された場合、これらの薬による治療は永久に
中止すること。
・高用量製剤の製品情報は改訂され、髄膜腫を追記予定
であること。
対応中
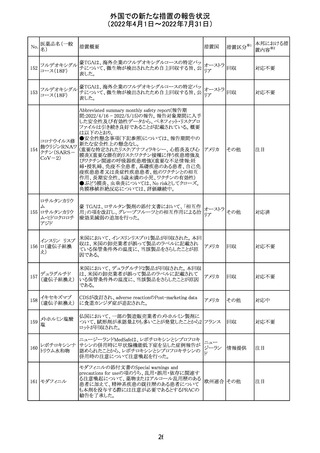
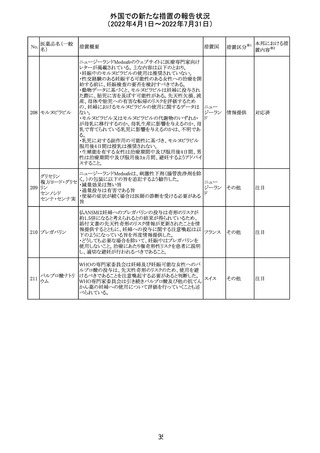
バルサルタン
カンデサルタン
シレキセチル
イルベサルタン
ロサルタンカリウ
ム
オルメサルタン
メドキソミル
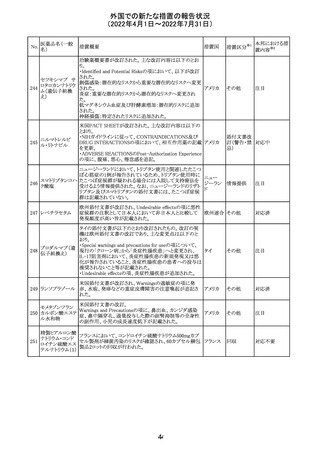
241 バルサルタン・ア
ムロジピンベシル
酸塩配合剤
ロサルタンカリウ
ム・ヒドロクロロチ
アジド
イルベサルタン・
アムロジピンベシ
ル酸塩配合剤
情報提供
対応不要
その他
対応済
その他
注目
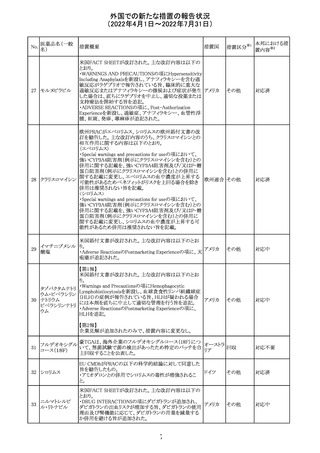
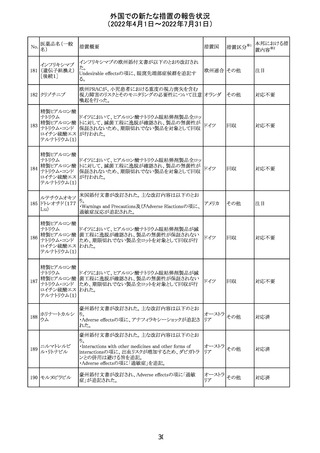
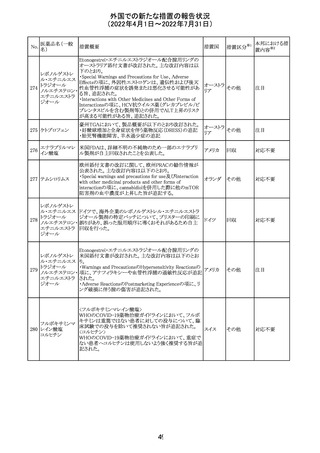
独 BfArMは、サルタン含有製剤(カンデサルタン、イルベサ
ルタン、ロサルタン、オルメサルタン、バルサルタン)の環構
造により合成されるニトロソアミン不純物が生成される可能
性があることを報告した。また計画されたリスク低減策をい ドイツ
まだ実施していない、あるいは完全に実施していない全て
の医薬品市販承認取得者については、計画されたリスク低
減策が完全に実施されるまで,製造販売承認を停止した。
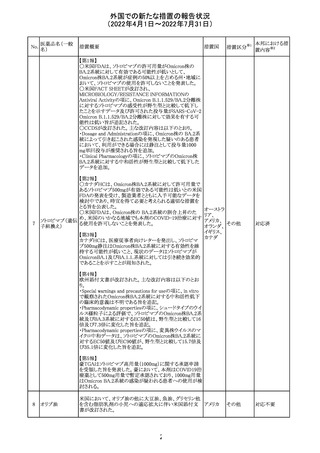
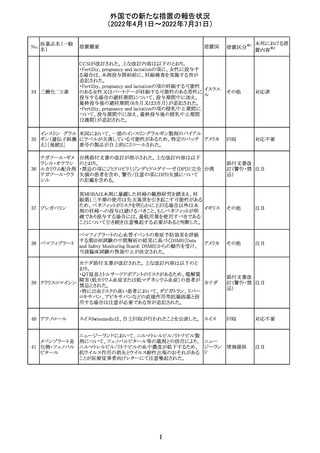
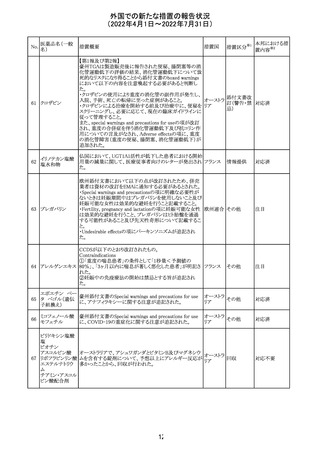
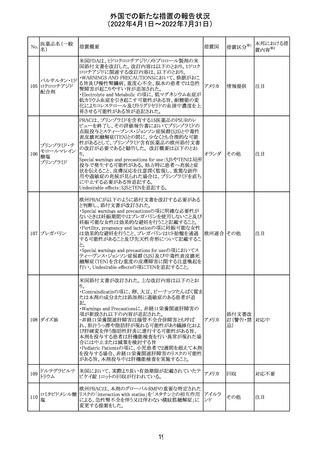
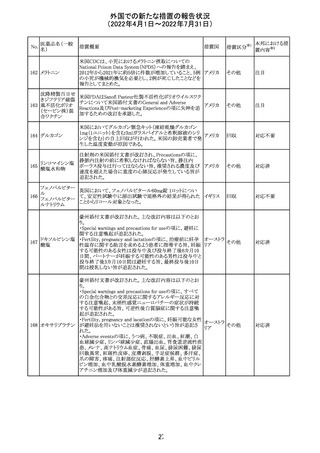
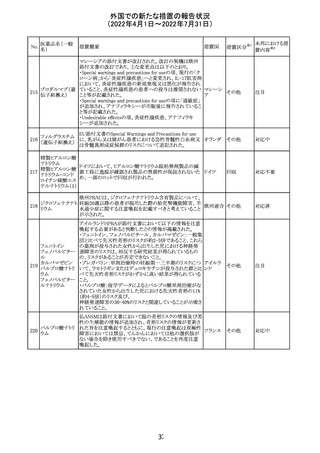
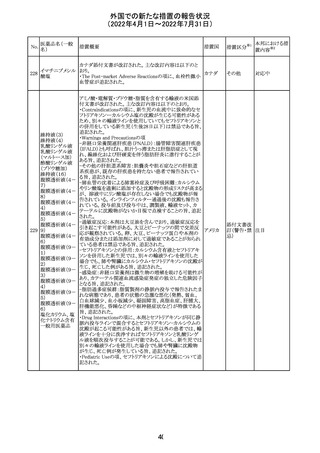
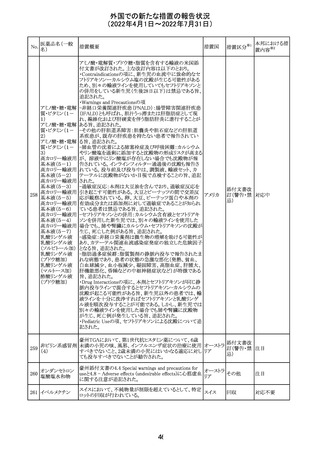
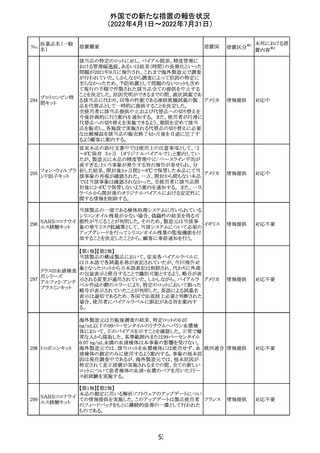
アモキシシリン、クラブラン酸カリウムの米国添付文書が改
訂された。主な改訂内容は以下のとおり。
・Warnings and Precautionsの項に「Severe Cutaneous
Adverse Reactions」の項を新設し、スティーヴンス・ジョンソ
ン症候群(SJS)、中毒性表皮壊死融解症(TEN)、好酸球増
アモキシシリン水
242
加と全身症状を伴う薬物反応(DRESS)、急性汎発性発疹 アメリカ
和物
性膿疱症(AGEP)を含む重症皮膚有害反応(SCAR)を引
き起こす可能性がある旨を追記。
・Adverse Reactionsの「Postmarketing Experience」の項に、
下痢、ショックを含むアナフィラキシー反応、嘔吐、DRESS、
無菌性髄膜炎を追記。
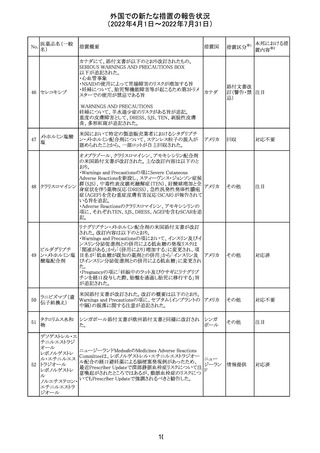
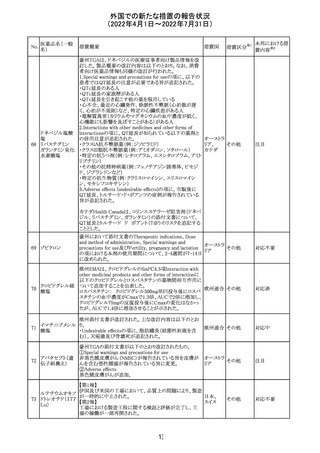
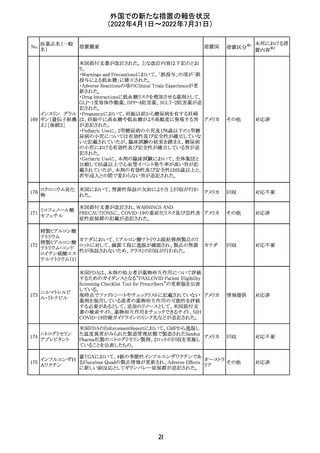
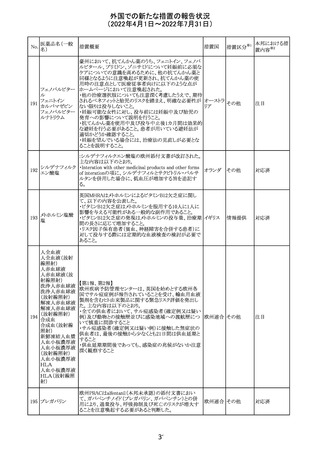
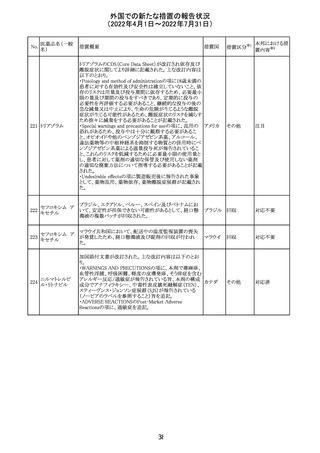
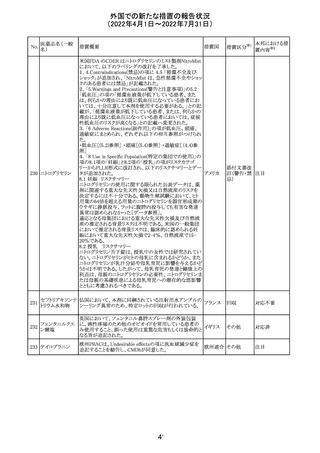
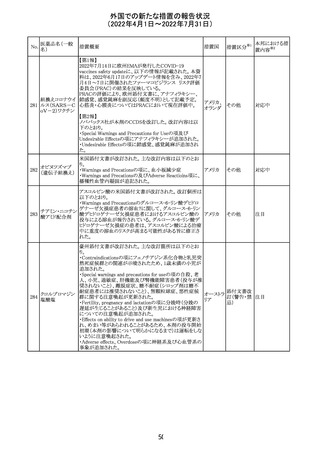
243 トルバプタン
サムスカの欧州添付文書が改訂された。Interaction with
other medicinal products and other forms of interaction 及
びPharmacokinetic properties の項に、以下の追記がなさ
れた。
・in-vitro試験においてトルバプタンはP-糖蛋白質(P-gp)
の基質及び競合的阻害剤であることが示されている。ジゴ ドイツ
キシンまたは他の狭い治療指数のP-gp基質(例:ダビガトラ
ンエテキシレート)の投与を受けている患者では注意が必
要である旨。
・トルバプタンはBCRP又はOTC1を阻害する可能性があり、
それらの基質との併用には注意が必要である旨。
43
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
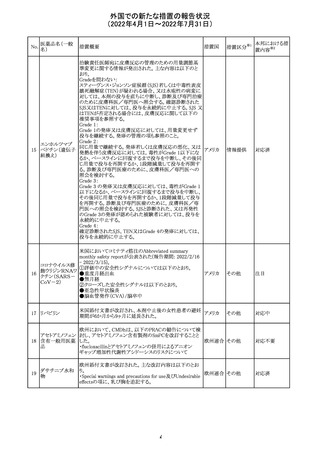
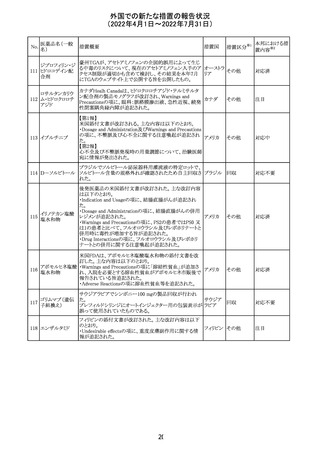
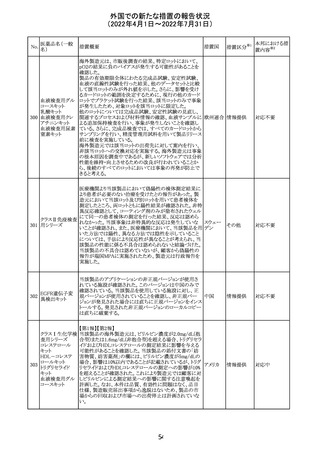
欧州PRACは、nomegesterolまたはクロルマジノン酢酸エス
テルを含有する医薬品の髄膜腫リスクについて、追加のリ
スク最小化策を推奨した。主な内容は以下のとおり。
・高用量クロルマジノン(5 - 10mg)または高用量
nomegesterol(3.75 - 5mg)を含む医薬品は、できるだけ有
効な最低量と最短期間で、他の介入が適切でない場合に
のみ使用すること。
クロルマジノン酢 ・低用量・高用量のnomegesterolやクロルマジノン製剤は、
240
欧州連合 その他
酸エステル
髄膜腫がある人、または既往のある人には使用しないこと。
・視力の変化、難聴や耳鳴り、嗅覚障害、頭痛、記憶喪失、
発作、手足の脱力など、髄膜腫の症状について患者をモニ
ターすること。
・髄膜腫と診断された場合、これらの薬による治療は永久に
中止すること。
・高用量製剤の製品情報は改訂され、髄膜腫を追記予定
であること。
対応中
バルサルタン
カンデサルタン
シレキセチル
イルベサルタン
ロサルタンカリウ
ム
オルメサルタン
メドキソミル
241 バルサルタン・ア
ムロジピンベシル
酸塩配合剤
ロサルタンカリウ
ム・ヒドロクロロチ
アジド
イルベサルタン・
アムロジピンベシ
ル酸塩配合剤
情報提供
対応不要
その他
対応済
その他
注目
独 BfArMは、サルタン含有製剤(カンデサルタン、イルベサ
ルタン、ロサルタン、オルメサルタン、バルサルタン)の環構
造により合成されるニトロソアミン不純物が生成される可能
性があることを報告した。また計画されたリスク低減策をい ドイツ
まだ実施していない、あるいは完全に実施していない全て
の医薬品市販承認取得者については、計画されたリスク低
減策が完全に実施されるまで,製造販売承認を停止した。
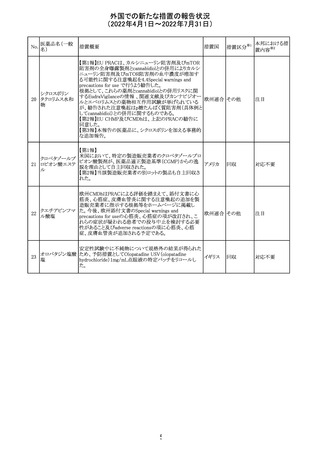
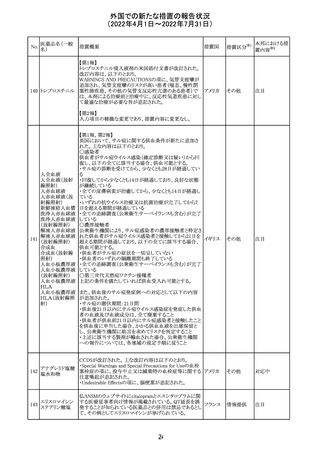
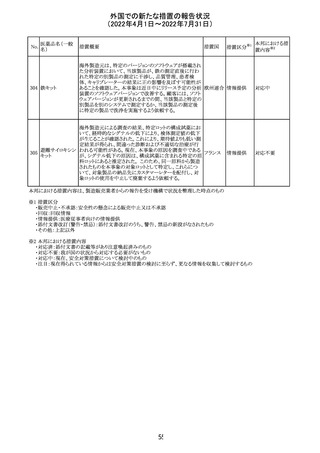
アモキシシリン、クラブラン酸カリウムの米国添付文書が改
訂された。主な改訂内容は以下のとおり。
・Warnings and Precautionsの項に「Severe Cutaneous
Adverse Reactions」の項を新設し、スティーヴンス・ジョンソ
ン症候群(SJS)、中毒性表皮壊死融解症(TEN)、好酸球増
アモキシシリン水
242
加と全身症状を伴う薬物反応(DRESS)、急性汎発性発疹 アメリカ
和物
性膿疱症(AGEP)を含む重症皮膚有害反応(SCAR)を引
き起こす可能性がある旨を追記。
・Adverse Reactionsの「Postmarketing Experience」の項に、
下痢、ショックを含むアナフィラキシー反応、嘔吐、DRESS、
無菌性髄膜炎を追記。
243 トルバプタン
サムスカの欧州添付文書が改訂された。Interaction with
other medicinal products and other forms of interaction 及
びPharmacokinetic properties の項に、以下の追記がなさ
れた。
・in-vitro試験においてトルバプタンはP-糖蛋白質(P-gp)
の基質及び競合的阻害剤であることが示されている。ジゴ ドイツ
キシンまたは他の狭い治療指数のP-gp基質(例:ダビガトラ
ンエテキシレート)の投与を受けている患者では注意が必
要である旨。
・トルバプタンはBCRP又はOTC1を阻害する可能性があり、
それらの基質との併用には注意が必要である旨。
43