総-6令和6年度診療報酬改定の結果検証に係る特別調査(令和6年度調査)の調査票案について (201 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45183.html |
| 出典情報 | 中央社会保険医療協議会 総会(第598回 11/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
⑪今後、どのような対応がなされれば、医師の立場として後発医薬品の使用を進めてもよいと思いますか。
※あてはまる番号すべてに○
1. 厚生労働省による、医師や薬剤師に対する後発医薬品の品質保証が十分であることの周知徹底
2. 後発医薬品メーカー・卸による品質保証が十分であること
3. 後発医薬品メーカー・卸による情報提供体制の確保
4. 後発医薬品に関する安定供給体制の確保
5. 後発医薬品の価格のバラツキや品目数の整理統合
6. 後発医薬品の在庫管理の負担軽減
7. 先発医薬品名を入力すると一般名処方できるオーダリングシステムの導入
8. 後発医薬品に対する患者の理解
9. 後発医薬品を使用する際の診療報酬上の評価
10. 後発医薬品の使用割合についての診療報酬上の評価
11. 後発医薬品の出荷停止・出荷調整等を含む安定供給に係る特例措置
12. 後発医薬品の原薬、製剤に関する製造方法、製造場所、製造国、共同開発などの情報開示
13. 調剤に関する保険薬局との連携
14. 患者負担が軽減されること
15. その他(具体的に:
)
16.特に対応は必要ない →質問⑬へ
⑫前記⑪の選択肢1.~15.のうち、最もあてはまるものの番号を1つだけお書きください。
⑬後発医薬品の使用促進について、国や地方自治体、製薬会社、医療関係者、国民においてどのような取組を行うこと
が効果的と考えますか。ご意見を自由にお書きください。
3.バイオ後続品の使用に関するお考えについてお伺いします。
注:バイオ後続品とは、国内で既に新有効成分含有医薬品として承認されたバイオテクノロジー応用医薬品(以下「先行バイ
オ医薬品」という。)と同等/同質の品質、安全性、有効性を有する医薬品として、異なる製造販売業者により開発され
る医薬品です。
本調査における「バイオ後続品」には、後発医薬品として承認されたバイオ医薬品(いわゆるバイオAG、先行品工場で製
造された先行品と同一のバイオ医薬品)を含みます。
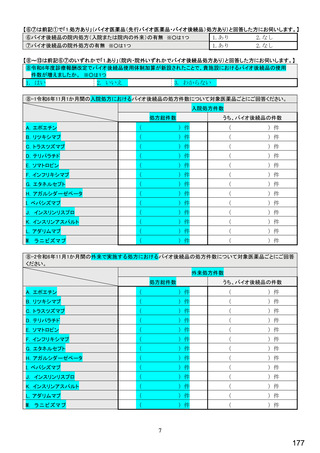
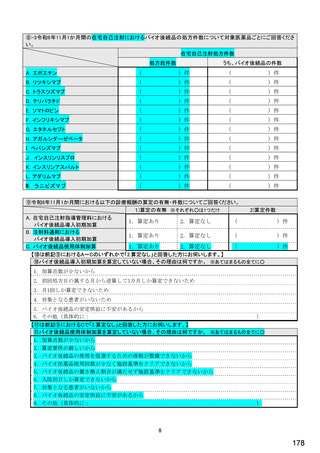
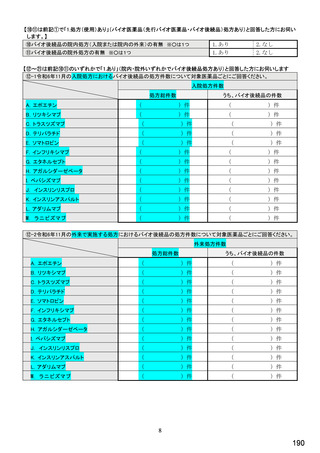
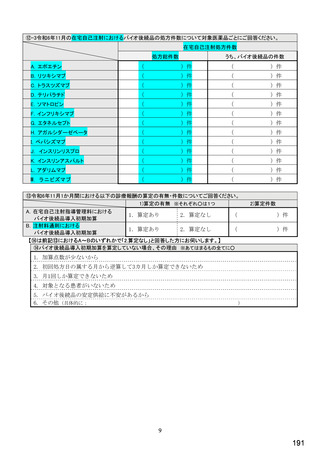
国内でバイオ後続品が承認されている先行バイオ医薬品
先行バイオ医薬品の一般的名称注1
先行バイオ医薬品 販売名
ソマトロピン
エポエチン アルファ
フィルグラスチム
インフリキシマブ
インスリン グラルギン
リツキシマブ
トラスツズマブ
エタネルセプト
アガルシダーゼ ベータ
ベバシズマブ
ダルベポエチン アルファ注2
テリパラチド
インスリン リスプロ
アダリムマブ
インスリン アスパルト
ラニビズマブ
ジェノトロピン
エスポー
グラン
レミケード
ランタス
リツキサン
ハーセプチン
エンブレル
ファブラザイム
アバスチン
ネスプ
フォルテオ
ヒューマログ
ヒュミラ
ノボラピッド
ルセンティス
注1:(遺伝子組換え)を省略して記載
注2:バイオ後続品と後発バイオ医薬品のそれぞれが承認されている
3
201