総-6令和6年度診療報酬改定の結果検証に係る特別調査(令和6年度調査)の調査票案について (203 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45183.html |
| 出典情報 | 中央社会保険医療協議会 総会(第598回 11/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
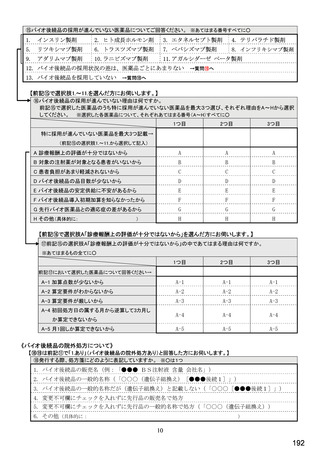
9. 院内でバイオ後続品の投与や処方を行っていないから
10. 在庫管理等の負担が大きいから
11.先行バイオ医薬品の薬価差がバイオ後続品の薬価差よりも大きいから
12. 先行バイオ医薬品とバイオ後続品の両方を備蓄するのは困難だから
13. 製造販売後調査(PMS)の手間が大きいから
14. 先行バイオ医薬品とバイオ後続品の適応症が異なるから
15. 先行バイオ医薬品とバイオ後続品のデバイスのタイプが異なるから
16. その他(具体的に:
)
【すべての方にお伺いします。】
⑨今後、どのような対応が進めば、バイオ後続品の使用を進めてよいと考えますか。 ※あてはまる番号すべてに○
1. 診療報酬上の評価
2. より患者負担が軽減されること
3. 医師、薬剤師への国からのバイオ後続品に関する情報の周知
4. 国からの国民への啓発と患者の理解
5. バイオ後続品企業からの情報提供
6. 先行バイオ医薬品からバイオ後続品に切り替えを含む臨床試験データの充実やガイドライン等の整備
7. バイオ後続品の品目数が増えること
8. バイオ後続品の供給がより安定すること
9. バイオ後続品の在庫の負担軽減
10. 医療機関に対する経営的メリットがあること
11. その他(具体的に:
)
12. バイオ後続品を使用する必要はない
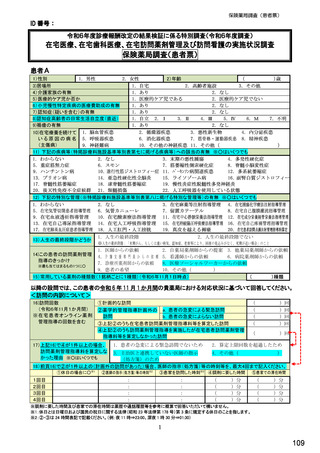
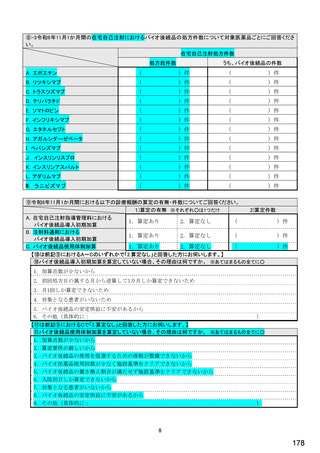
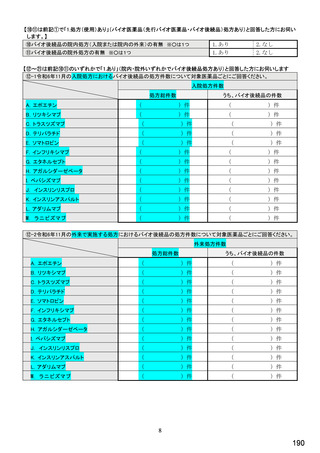
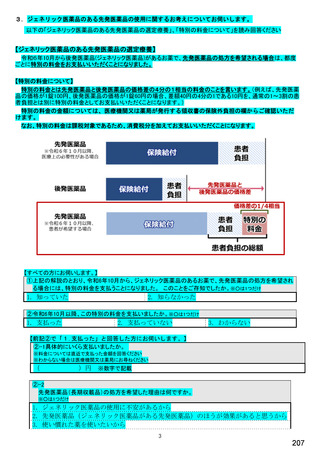
【⑩⑪は前記①で「1.処方あり」(バイオ医薬品(先行バイオ医薬品・バイオ後続品)処方あり)と回答した方にお伺いします。】
⑩バイオ後続品の院内処方(入院または院内の外来)の有無 ※○は1つ
1.あり
2.なし
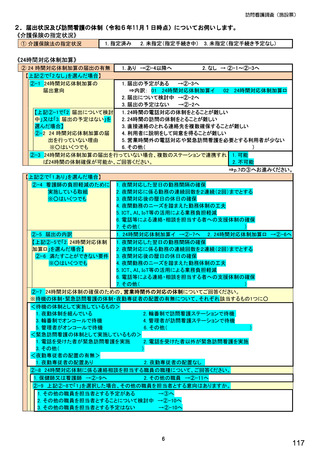
⑪バイオ後続品の院外処方の有無 ※○は1つ
【すべての方にお伺いします。】
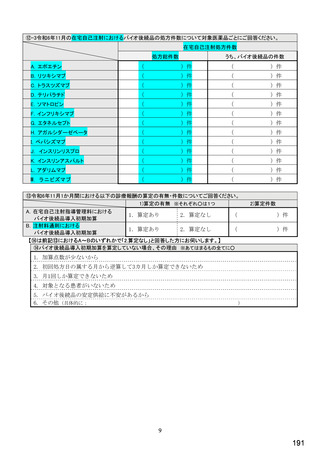
⑫令和6年診療報酬改定でバイオ後続品使用体制加算が新設されたことを知って
いますか。 ※○は 1 つ
1.あり
2.なし
1.知っている
2.知らない
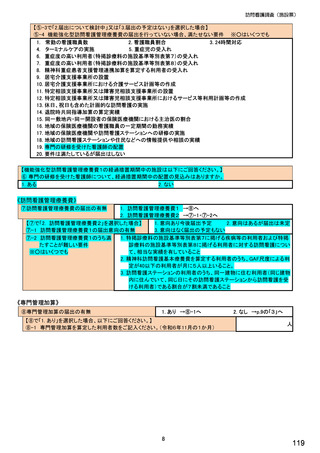
【⑬は前記⑫で「1.知っている」と回答した方にお伺いします。】
⑬令和6年度診療報酬改定でバイオ後続品使用体制加算が新設されたことで、バイオ後続品の使用件数が増えまし
たか。 ※○は 1 つ
1. はい
2. いいえ
3. わからない
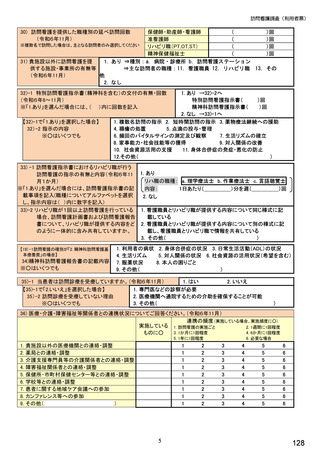
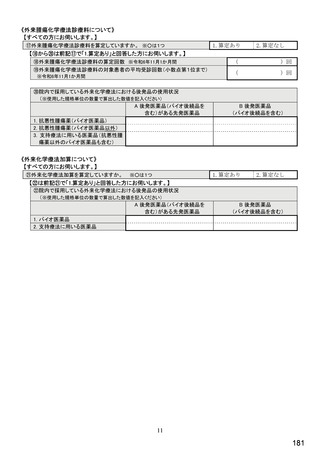
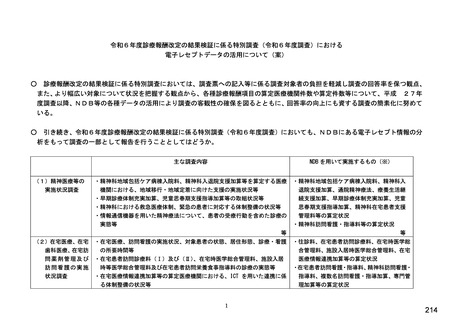
《バイオ後続品の院外処方について》
【⑭⑮は前記⑪で「1.あり」(バイオ後続品の院外処方あり)と回答した方にお伺いします。】
⑭発行する際、処方箋にどのように表記していますか。 ※○は 1 つ
1. バイオ後続品の販売名(例:「●●● BS注射液 含量 会社名」)
2. バイオ後続品の一般的名称(「○○○(遺伝子組換え)[●●●後続1]」)
3. バイオ後続品の一般的名称だが(遺伝子組換え)と記載しない(「○○○[●●●後続1]」)
4. 変更不可欄にチェックを入れずに先行品の販売名で処方
5. 変更不可欄にチェックを入れずに先行品の一般的名称で処方(「○○○(遺伝子組換え))
6. その他(具体的に:
)
⑮バイオ後続品を院外処方するにあたって薬局・薬剤師に望むことはありますか。 ※あてはまる番号すべてに○
1. 「一般名処方の調剤」または「バイオ後続品への変更調剤」について、予め合意した方法で情報提
供を受けること
2. 「一般名処方の調剤」または「バイオ後続品への変更調剤」について、合意方法や頻度によらず情
報提供を受けること
3. 患者に対して、バイオ後続品の品質や有効性、安全性について説明を行うこと
4. 患者に対して、バイオ後続品の普及啓発を行うこと
5. その他(具体的に:
)
5
203