よむ、つかう、まなぶ。
別紙1○先進医療Bに係る新規技術の科学的評価等について (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00069.html |
| 出典情報 | 先進医療会議(第131回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
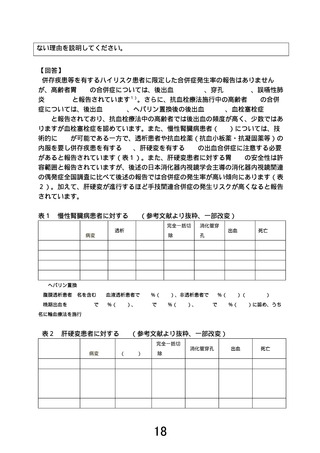
先進医療審査の事前照会事項に対する回答3
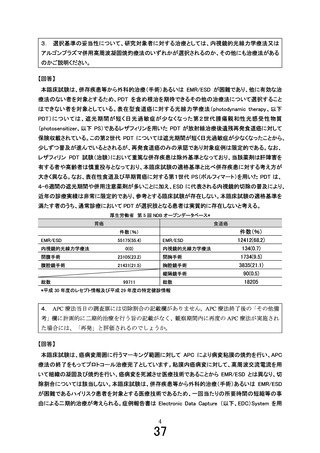
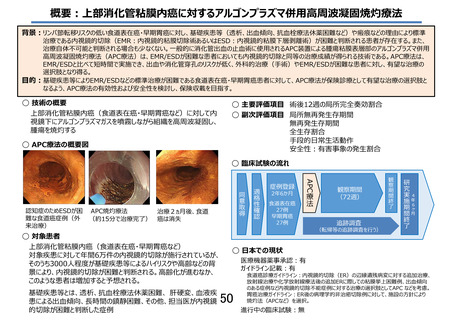
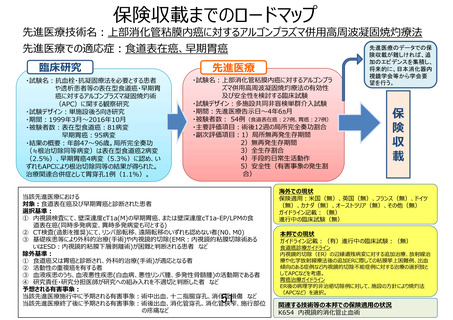
先進医療技術名: 上部消化管粘膜内癌に対するアルゴンプラズマ併用高周波凝固焼灼療法
2023 年 8 月 24 日
所属・氏名: 北海道大学病院 光学診療部 小野尚子
北里大学病院 消化器内科 田邉聡、石戸 謙次
北海道大学病院 医療・ヘルスサイエンス研究開発機構 伊藤陽一 渡邊祐介
(同意説明文書について)
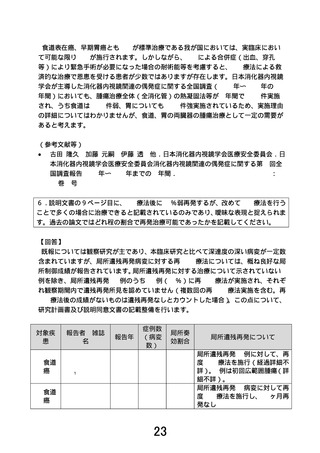
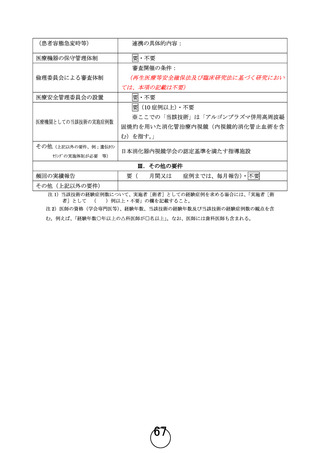
1. P.8 「研究の実施予定期間」に、72 週までは経過観察を行うとありますが、再発評価について 72
週で十分なのでしょうか。また「追跡調査の期間に応じで最大で 4 年 6 ヵ月までとなることがあり
ます」と記載されていますが、追跡調査の期間は患者毎に設定されるのでしょうか。追跡調査と
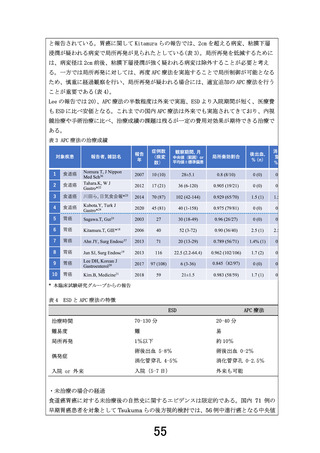
いうのは、どのくらいの間隔で、どのような調査が実施されるのでしょうか。(p10 表3.検査スケジ
ュールでは、〇b として「…研究実施期間終了まで年 1 回以上及び必要に応じて病状の変化や再
発の有無等の調査を行います。」と記載がありますが、本文において追跡調査のご説明はされる
必要があると考えます。)
【回答】
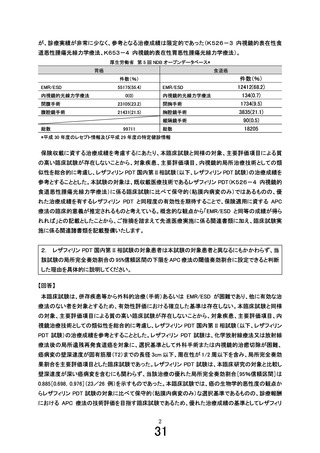
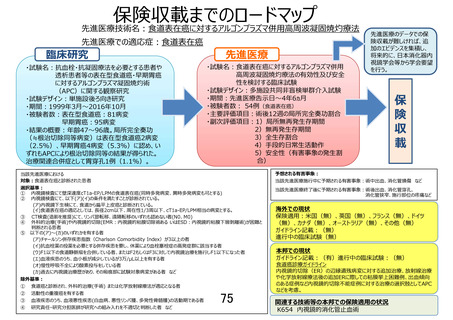
本臨床試験では、リンパ節転移の可能性が非常に低い早期癌に対する局所治療である APC 療法に
関する短期的な有効性を評価するため、3 年生存率としました。本臨床研究の対象は、基礎疾患等によ
り外科的治療(手術)あるいは EMR、ESD が不耐と考えられる集団であり、5 年生存割合は原病死よりも
他病死が大きく影響することが予想され、補正生存率(cause-specific survival)は統計学的に競合リス
クの問題が生じること、基礎疾患の改善等により診療として行われる可能性がある外科的治療(手術)
や EMR、ESD によって生じる合併症の死因に対する影響など、当該医療技術を正確に評価できる保証
がないと考えています。本臨床試験における追跡調査は研究期間内の実施であります。追跡調査は組
み入れ時期の影響を受けるため、臨床試験早期に組み入れられた研究対象者については最大で 4 年
6 ヶ月となります。患者さんへの説明文書の6.研究の方法(2)研究スケジュールの項に追跡調査につい
て記載しておりますが、ご指摘の点を踏まえ、説明同意書の記載整備を行います。
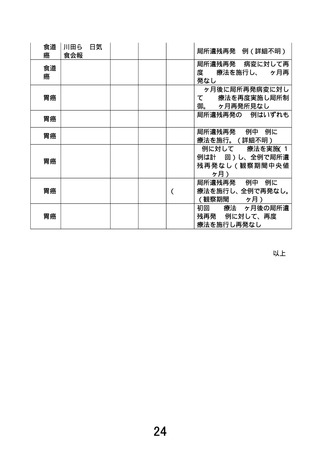
2.P.8 「予想される利益」の2行目「EMR や ESD の実施が困難な患者さんにも治療を受けていただく
ことが可能になります。」と書かれていますが、本研究へ参加される患者さんに予想される利益と
しては「EMR や ESD の実施が困難な患者さんにも本研究において治療を受けていただけること。」
となるのではないでしょうか。現行の表現では、本研究の成果が得られた場合に、後の同様の状
態の患者さんに当該治療を受けていただくことが可能になるという意味に読めます。将来の患者
への利益(社会の利益)と被験者個人の利益を混同しないようご説明ください。
【回答】
1
39
15
先進医療技術名: 上部消化管粘膜内癌に対するアルゴンプラズマ併用高周波凝固焼灼療法
2023 年 8 月 24 日
所属・氏名: 北海道大学病院 光学診療部 小野尚子
北里大学病院 消化器内科 田邉聡、石戸 謙次
北海道大学病院 医療・ヘルスサイエンス研究開発機構 伊藤陽一 渡邊祐介
(同意説明文書について)
1. P.8 「研究の実施予定期間」に、72 週までは経過観察を行うとありますが、再発評価について 72
週で十分なのでしょうか。また「追跡調査の期間に応じで最大で 4 年 6 ヵ月までとなることがあり
ます」と記載されていますが、追跡調査の期間は患者毎に設定されるのでしょうか。追跡調査と
いうのは、どのくらいの間隔で、どのような調査が実施されるのでしょうか。(p10 表3.検査スケジ
ュールでは、〇b として「…研究実施期間終了まで年 1 回以上及び必要に応じて病状の変化や再
発の有無等の調査を行います。」と記載がありますが、本文において追跡調査のご説明はされる
必要があると考えます。)
【回答】
本臨床試験では、リンパ節転移の可能性が非常に低い早期癌に対する局所治療である APC 療法に
関する短期的な有効性を評価するため、3 年生存率としました。本臨床研究の対象は、基礎疾患等によ
り外科的治療(手術)あるいは EMR、ESD が不耐と考えられる集団であり、5 年生存割合は原病死よりも
他病死が大きく影響することが予想され、補正生存率(cause-specific survival)は統計学的に競合リス
クの問題が生じること、基礎疾患の改善等により診療として行われる可能性がある外科的治療(手術)
や EMR、ESD によって生じる合併症の死因に対する影響など、当該医療技術を正確に評価できる保証
がないと考えています。本臨床試験における追跡調査は研究期間内の実施であります。追跡調査は組
み入れ時期の影響を受けるため、臨床試験早期に組み入れられた研究対象者については最大で 4 年
6 ヶ月となります。患者さんへの説明文書の6.研究の方法(2)研究スケジュールの項に追跡調査につい
て記載しておりますが、ご指摘の点を踏まえ、説明同意書の記載整備を行います。
2.P.8 「予想される利益」の2行目「EMR や ESD の実施が困難な患者さんにも治療を受けていただく
ことが可能になります。」と書かれていますが、本研究へ参加される患者さんに予想される利益と
しては「EMR や ESD の実施が困難な患者さんにも本研究において治療を受けていただけること。」
となるのではないでしょうか。現行の表現では、本研究の成果が得られた場合に、後の同様の状
態の患者さんに当該治療を受けていただくことが可能になるという意味に読めます。将来の患者
への利益(社会の利益)と被験者個人の利益を混同しないようご説明ください。
【回答】
1
39
15