よむ、つかう、まなぶ。
別紙1○先進医療Bに係る新規技術の科学的評価等について (83 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00069.html |
| 出典情報 | 先進医療会議(第131回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【別添3】
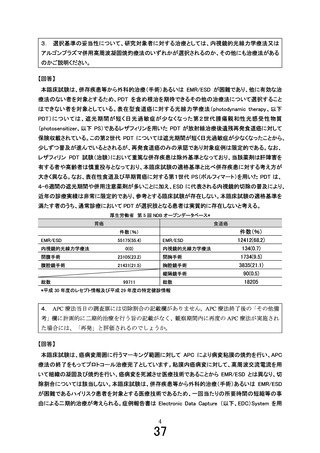
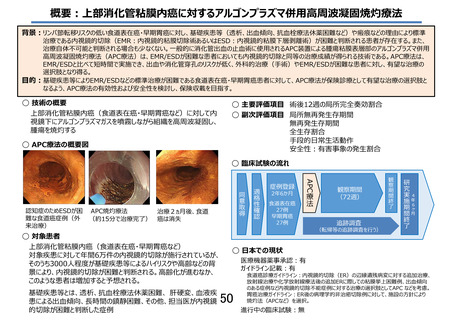
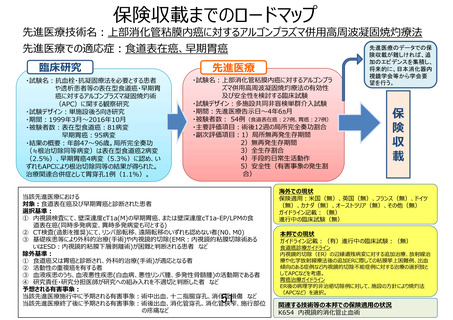
「食道表在癌に対するアルゴンプラズマ併用高周波凝固焼灼療法」の
被験者の適格基準及び選定方法(申請書類より抜粋)
5.被験者の適格基準及び選定方法
本研究は、20 歳以上の男女で食道表在癌を有し、EMR や ESD が不耐と考えられる患者を対象に APC 療
法を行い、術後 12 週の局所完全奏効割合及び局所無再発生存期間、無再発生存期間、安全性等を検討す
る多施設共同単群臨床試験として実施する。
5.1 対象者
本研究に参加する実施医療機関に通院又は入院中の食道表在癌と診断された患者を対象とする。
5.2
選択基準
以下の基準を全て満たす患者を対象とする。
1) 内視鏡検査にて、壁深達度 cT1a-EP/LPM の食道表在癌である。同時多発病変、異時多発病変も
可。他の癌腫に対する治療も含めて、頸部、胸部、腹部への放射線治療や化学療法、内分泌療法の
既往の有無は問わない。
2) 内視鏡検査にて、以下(ア)(イ)の条件を満たすことが診断されている。なお組織型については、前医
からの借用標本または病理診断レポートにて確認できれば研究対象者登録施設での生検を必須とは
しない。
(ア)内視鏡下生検にて、食道から扁平上皮癌と診断されている。
(イ)食道表在癌の適応としては、長径 2cm 以下、周在性 1/3 周以下、cT1a-EP/LPM 相当の病変と
する。
3) CT 検査(造影を推奨)にて、リンパ節転移、遠隔転移のいずれも認めない(N0、M0)
4) 外科的治療(手術)あるいは EMR、ESD の実施が困難と判断される者
5) 以下の(ア)~(カ)のいずれかを有する者
(ア)チャールソン併存疾患指数(Charlson comorbidity index)が 3 以上の者
(イ)抗血栓薬の投薬を必要とする併存疾患を要し、休薬により血栓塞栓症の高発症群*に該当する
者
*「抗血栓薬服用者に対する消化器内視鏡診療ガイドライン Vol.54(7),Jul.2012」28)参照
(ウ)F1 以下の食道静脈瘤を合併している者、または F2 もしくは F3 に対して内視鏡治療を施行し
F1 以下になった者
(エ)血液疾患のうち、血小板が減少しているが 3 万/µL 以上を有する者
(オ)慢性呼吸不全により酸素投与をしている者
(カ)過去に内視鏡治療歴があり、その瘢痕部に試験対象病変がある者
6) ECOG Performance Status (PS) 1~3 の者(PS Score が 4 の患者は除く)
7) 同意取得時の年齢が 20 歳以上の男女
8) 研究参加に関して患者本人、若しくは代諾者からの文書による同意が得られた者
5.3
除外基準
1)食道癌と診断され、外科的治療(手術) または化学放射線療法が適応となる者
2)活動性の重複癌を有する(同時性重複癌および無病期間が 5 年以内の異時性重複癌)者。ただし、無病期
間が 5 年未満であっても、臨床病期 I 期の前立腺癌、放射線治療で完全奏効となった臨床病期 0 期、I 期
の喉頭癌、完全切除された以下の病期のように、5 年相対生存率 95%以上相当の以下の病期分類の癌の既
往も活動性重複癌に含めない。
・食道癌(扁平上皮癌、腺扁平上皮癌、類基底細胞癌):0 期
・胃癌(腺癌):0-I 期
・結腸癌(腺癌):0-I 期
83
「食道表在癌に対するアルゴンプラズマ併用高周波凝固焼灼療法」の
被験者の適格基準及び選定方法(申請書類より抜粋)
5.被験者の適格基準及び選定方法
本研究は、20 歳以上の男女で食道表在癌を有し、EMR や ESD が不耐と考えられる患者を対象に APC 療
法を行い、術後 12 週の局所完全奏効割合及び局所無再発生存期間、無再発生存期間、安全性等を検討す
る多施設共同単群臨床試験として実施する。
5.1 対象者
本研究に参加する実施医療機関に通院又は入院中の食道表在癌と診断された患者を対象とする。
5.2
選択基準
以下の基準を全て満たす患者を対象とする。
1) 内視鏡検査にて、壁深達度 cT1a-EP/LPM の食道表在癌である。同時多発病変、異時多発病変も
可。他の癌腫に対する治療も含めて、頸部、胸部、腹部への放射線治療や化学療法、内分泌療法の
既往の有無は問わない。
2) 内視鏡検査にて、以下(ア)(イ)の条件を満たすことが診断されている。なお組織型については、前医
からの借用標本または病理診断レポートにて確認できれば研究対象者登録施設での生検を必須とは
しない。
(ア)内視鏡下生検にて、食道から扁平上皮癌と診断されている。
(イ)食道表在癌の適応としては、長径 2cm 以下、周在性 1/3 周以下、cT1a-EP/LPM 相当の病変と
する。
3) CT 検査(造影を推奨)にて、リンパ節転移、遠隔転移のいずれも認めない(N0、M0)
4) 外科的治療(手術)あるいは EMR、ESD の実施が困難と判断される者
5) 以下の(ア)~(カ)のいずれかを有する者
(ア)チャールソン併存疾患指数(Charlson comorbidity index)が 3 以上の者
(イ)抗血栓薬の投薬を必要とする併存疾患を要し、休薬により血栓塞栓症の高発症群*に該当する
者
*「抗血栓薬服用者に対する消化器内視鏡診療ガイドライン Vol.54(7),Jul.2012」28)参照
(ウ)F1 以下の食道静脈瘤を合併している者、または F2 もしくは F3 に対して内視鏡治療を施行し
F1 以下になった者
(エ)血液疾患のうち、血小板が減少しているが 3 万/µL 以上を有する者
(オ)慢性呼吸不全により酸素投与をしている者
(カ)過去に内視鏡治療歴があり、その瘢痕部に試験対象病変がある者
6) ECOG Performance Status (PS) 1~3 の者(PS Score が 4 の患者は除く)
7) 同意取得時の年齢が 20 歳以上の男女
8) 研究参加に関して患者本人、若しくは代諾者からの文書による同意が得られた者
5.3
除外基準
1)食道癌と診断され、外科的治療(手術) または化学放射線療法が適応となる者
2)活動性の重複癌を有する(同時性重複癌および無病期間が 5 年以内の異時性重複癌)者。ただし、無病期
間が 5 年未満であっても、臨床病期 I 期の前立腺癌、放射線治療で完全奏効となった臨床病期 0 期、I 期
の喉頭癌、完全切除された以下の病期のように、5 年相対生存率 95%以上相当の以下の病期分類の癌の既
往も活動性重複癌に含めない。
・食道癌(扁平上皮癌、腺扁平上皮癌、類基底細胞癌):0 期
・胃癌(腺癌):0-I 期
・結腸癌(腺癌):0-I 期
83