よむ、つかう、まなぶ。
参考資料1-2 TERMS®サリドマイド製剤等安全管理手順[6.2MB] (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40908.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第3回 6/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
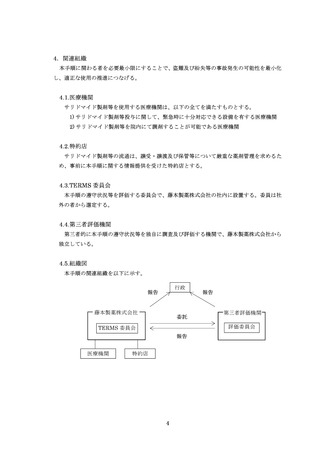
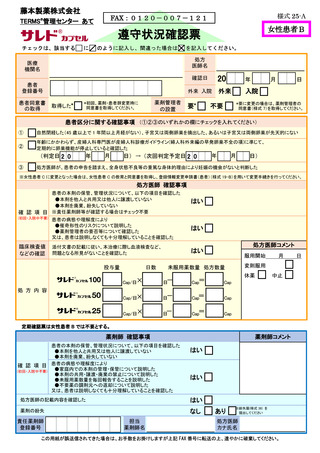
【薬剤管理者の要否の確認】
処方医師は薬剤管理者の要否を確認し、新たに薬剤管理者の設置を要と判断した場合
には、薬剤管理者への教育を行い、薬剤管理者の同意書を取得する。
薬剤管理者の要否の変更は、遵守状況確認票(又は登録情報変更申請書)にて行う。
【諸検査の実施】
女性患者 C については、医療機関にて妊娠検査(8.3.1.妊娠検査参照)を実施し、検
査結果が陰性であることを確認する。
また、すべての患者に対し、定期的に血液検査等を実施し、血液毒性等の発現に注意
する。
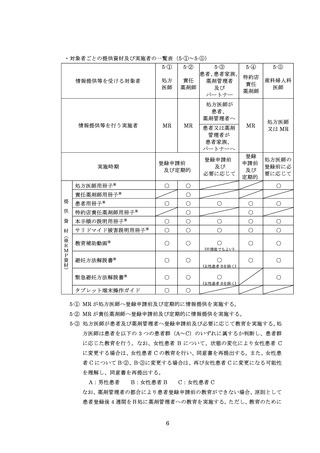
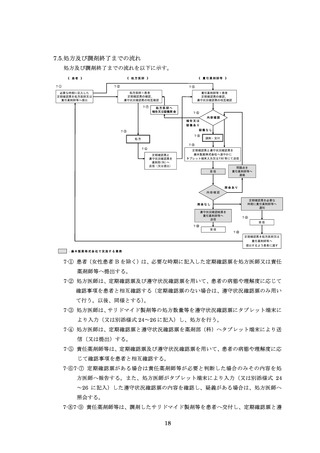
【処方時の手順】(括弧内の 7-①~7-④は、「7.5.処方及び調剤終了までの流れ」の図中番
号を示す )
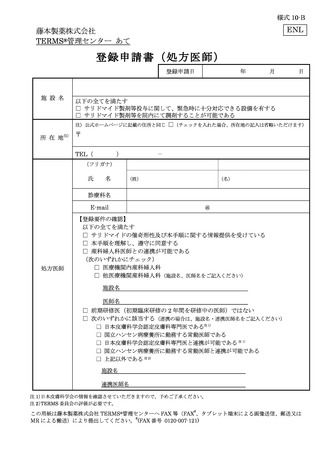
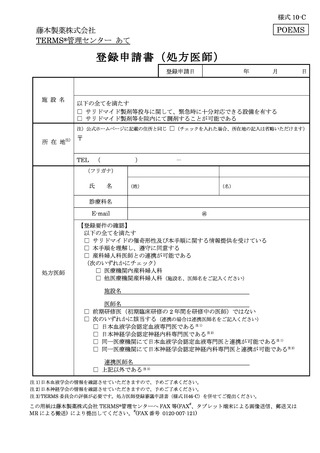
患者(女性患者 B を除く)は、必要な時期に記入した定期確認票(別添様式 21、23)
を処方医師又は責任薬剤師等へ提出する(入院中は除く)(7-①)。
処方医師は、定期確認票がある場合は定期確認票及び遵守状況確認票(別添様式 24
~26)を用いて、定期確認票のない場合は遵守状況確認票のみを用いて、患者の病態や
理解度に応じて確認事項を患者と相互確認(初回処方時及び入院患者は確認不要)する
(7-②)。その上で、サリドマイド製剤等の処方数量等を遵守状況確認票にタブレット端
末により入力(又は別添様式 24~26 に記入)し薬剤部(科)へ送信(又は提出)する。
定期確認票がある場合は定期確認票を薬剤部(科)へ提出する(7-③、7-④)。
処方までの流れを 7.5.に示す。
サレドカプセルの 1 回の処方量は 12 週間分を超えないものとする。
7.3.調剤
サリドマイド製剤等の調剤は、責任薬剤師等が実施する。責任薬剤師等は、藤本製薬株式
会社への登録が完了した患者へ調剤したサリドマイド製剤等を交付する。
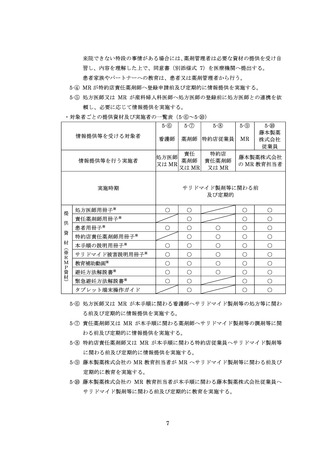
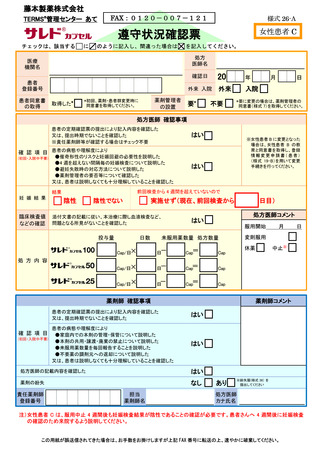
【調剤時の手順】( 括弧内の 7-⑤~7-⑩は、「7.5.処方及び調剤終了までの流れ」の図中番
号を示す )
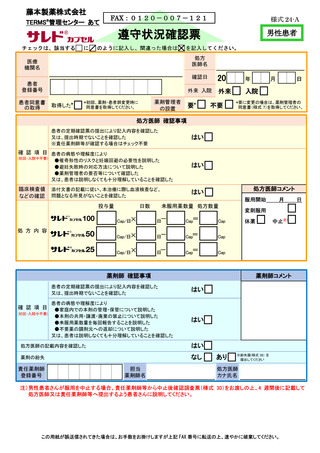
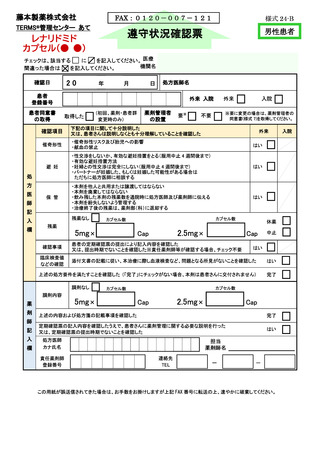
責任薬剤師等は、定期確認票がある場合は定期確認票及び遵守状況確認票を用いて、
定期確認票のない場合は遵守状況確認票のみを用いて、患者の病態や理解度に応じて確
認事項を患者と相互確認(初回調剤時及び入院患者は確認不要)する(7-⑤)。定期確認
票がある場合は責任薬剤師等が必要と判断した場合のみその内容を処方医師へ報告す
る。また、処方医師がタブレット端末により入力(又は別添様式 24~26 に記入)した
患者登録番号、処方数量等を確認し、内容に疑義がある場合は、処方医師へ照会する(7⑥、7-⑦)。遵守状況確認票に疑義がない場合は、調剤したサリドマイド製剤等を患者へ
交付し、確認した遵守状況確認票(定期確認票がある場合は併せて)を速やかに藤本製
薬株式会社へタブレット端末入力又は FAX 等により送信する(7-⑧、7-⑨)。
藤本製薬株式会社は、受信した遵守状況確認票を確認し、照会がない場合は、遵守状
16
処方医師は薬剤管理者の要否を確認し、新たに薬剤管理者の設置を要と判断した場合
には、薬剤管理者への教育を行い、薬剤管理者の同意書を取得する。
薬剤管理者の要否の変更は、遵守状況確認票(又は登録情報変更申請書)にて行う。
【諸検査の実施】
女性患者 C については、医療機関にて妊娠検査(8.3.1.妊娠検査参照)を実施し、検
査結果が陰性であることを確認する。
また、すべての患者に対し、定期的に血液検査等を実施し、血液毒性等の発現に注意
する。
【処方時の手順】(括弧内の 7-①~7-④は、「7.5.処方及び調剤終了までの流れ」の図中番
号を示す )
患者(女性患者 B を除く)は、必要な時期に記入した定期確認票(別添様式 21、23)
を処方医師又は責任薬剤師等へ提出する(入院中は除く)(7-①)。
処方医師は、定期確認票がある場合は定期確認票及び遵守状況確認票(別添様式 24
~26)を用いて、定期確認票のない場合は遵守状況確認票のみを用いて、患者の病態や
理解度に応じて確認事項を患者と相互確認(初回処方時及び入院患者は確認不要)する
(7-②)。その上で、サリドマイド製剤等の処方数量等を遵守状況確認票にタブレット端
末により入力(又は別添様式 24~26 に記入)し薬剤部(科)へ送信(又は提出)する。
定期確認票がある場合は定期確認票を薬剤部(科)へ提出する(7-③、7-④)。
処方までの流れを 7.5.に示す。
サレドカプセルの 1 回の処方量は 12 週間分を超えないものとする。
7.3.調剤
サリドマイド製剤等の調剤は、責任薬剤師等が実施する。責任薬剤師等は、藤本製薬株式
会社への登録が完了した患者へ調剤したサリドマイド製剤等を交付する。
【調剤時の手順】( 括弧内の 7-⑤~7-⑩は、「7.5.処方及び調剤終了までの流れ」の図中番
号を示す )
責任薬剤師等は、定期確認票がある場合は定期確認票及び遵守状況確認票を用いて、
定期確認票のない場合は遵守状況確認票のみを用いて、患者の病態や理解度に応じて確
認事項を患者と相互確認(初回調剤時及び入院患者は確認不要)する(7-⑤)。定期確認
票がある場合は責任薬剤師等が必要と判断した場合のみその内容を処方医師へ報告す
る。また、処方医師がタブレット端末により入力(又は別添様式 24~26 に記入)した
患者登録番号、処方数量等を確認し、内容に疑義がある場合は、処方医師へ照会する(7⑥、7-⑦)。遵守状況確認票に疑義がない場合は、調剤したサリドマイド製剤等を患者へ
交付し、確認した遵守状況確認票(定期確認票がある場合は併せて)を速やかに藤本製
薬株式会社へタブレット端末入力又は FAX 等により送信する(7-⑧、7-⑨)。
藤本製薬株式会社は、受信した遵守状況確認票を確認し、照会がない場合は、遵守状
16