よむ、つかう、まなぶ。
参考資料1-2 TERMS®サリドマイド製剤等安全管理手順[6.2MB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40908.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第3回 6/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1.背景
サリドマイドは、1950 年代後半に催眠鎮静薬としてドイツで開発された薬剤であり、本邦を
含む世界各国で広く使用された。しかし、1960 年代初頭、サリドマイドを妊娠中に服用した場
合、胎児への重大な障害や死産を引き起こすことが明らかとなり、販売の中止と回収が行われ
た。
このように、サリドマイドは医薬品市場から撤退したにもかかわらず、その後も薬効の研究
は続けられ、1998 年に米国 FDA はらい性結節性紅斑を適応症として厳重な管理システムのも
とにサリドマイドの使用を承認した。また、1999 年に多発性骨髄腫に対する有効性が米国で報
告される等、その開発が国際的に続けられ、米国をはじめ世界各国で厳格な安全管理のもとで
の使用を条件に承認された。
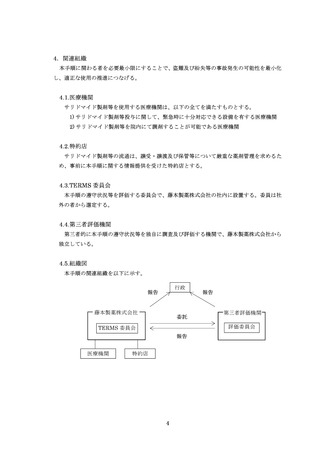
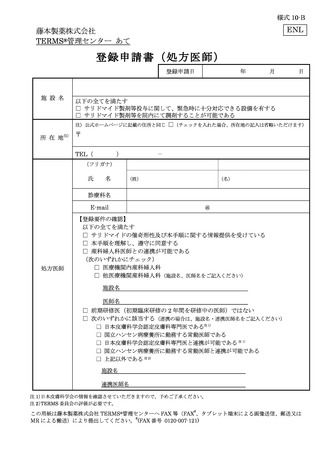
藤本製薬株式会社は、サリドマイド製剤であるサレドカプセルの製造販売承認申請にあたり、
本邦の医療現場にあった安全管理手順が必要と考え、関係者の意見を伺いながら、情報提供及
び教育、登録、中央一元管理、評価を重要な構成要素とするサリドマイド製剤安全管理手順
(TERMS®)を作成した。
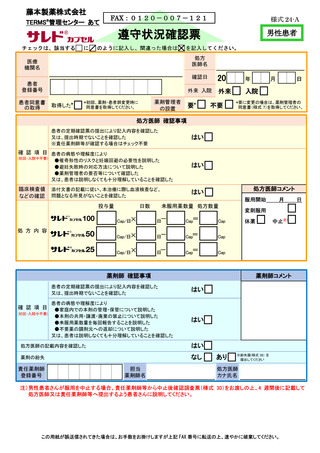
サレドカプセルが 2008 年 10 月に「再発又は難治性の多発性骨髄腫」の治療薬として承認を
受けて以来、サリドマイド製剤安全管理手順(TERMS®)の実施状況等の調査結果を踏まえ、
患者の治療アクセスを阻害することなく胎児曝露を防止するという観点から、必要な改訂を行
ってきた。
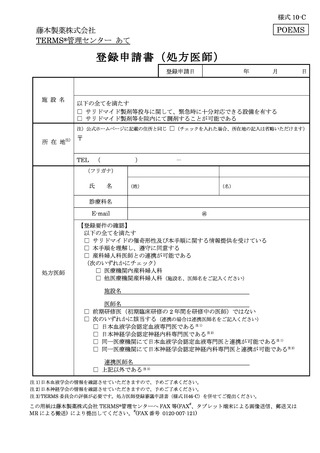
2012 年 5 月に「らい性結節性紅斑」、2021 年 2 月に「クロウ・深瀬(POEMS)症候群」の
効能・効果の追加承認を取得し、その都度改訂を行ってきた。
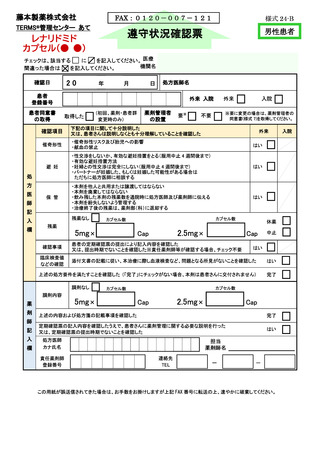
このたび、新たに製造販売するレナリドミドカプセルは、サリドマイドの誘導体を主成分と
していることから、サレドカプセルとレナリドミドカプセルの両方を厳格に管理し、医療現場
及び患者の負担を軽減するようサリドマイド製剤等安全管理手順(TERMS®)に改訂した。
2.目的
本手順は、藤本製薬株式会社が製造販売承認を受けたサレドカプセル、レナリドミドカプセ
ル(以下、
「サリドマイド製剤等」という)を厳格に管理し、併せてこの厳格な管理を基盤とし
たサリドマイド製剤等の適正な使用を推進し、サリドマイド製剤等の胎児への曝露を防止する
ことを目的とする。
1
サリドマイドは、1950 年代後半に催眠鎮静薬としてドイツで開発された薬剤であり、本邦を
含む世界各国で広く使用された。しかし、1960 年代初頭、サリドマイドを妊娠中に服用した場
合、胎児への重大な障害や死産を引き起こすことが明らかとなり、販売の中止と回収が行われ
た。
このように、サリドマイドは医薬品市場から撤退したにもかかわらず、その後も薬効の研究
は続けられ、1998 年に米国 FDA はらい性結節性紅斑を適応症として厳重な管理システムのも
とにサリドマイドの使用を承認した。また、1999 年に多発性骨髄腫に対する有効性が米国で報
告される等、その開発が国際的に続けられ、米国をはじめ世界各国で厳格な安全管理のもとで
の使用を条件に承認された。
藤本製薬株式会社は、サリドマイド製剤であるサレドカプセルの製造販売承認申請にあたり、
本邦の医療現場にあった安全管理手順が必要と考え、関係者の意見を伺いながら、情報提供及
び教育、登録、中央一元管理、評価を重要な構成要素とするサリドマイド製剤安全管理手順
(TERMS®)を作成した。
サレドカプセルが 2008 年 10 月に「再発又は難治性の多発性骨髄腫」の治療薬として承認を
受けて以来、サリドマイド製剤安全管理手順(TERMS®)の実施状況等の調査結果を踏まえ、
患者の治療アクセスを阻害することなく胎児曝露を防止するという観点から、必要な改訂を行
ってきた。
2012 年 5 月に「らい性結節性紅斑」、2021 年 2 月に「クロウ・深瀬(POEMS)症候群」の
効能・効果の追加承認を取得し、その都度改訂を行ってきた。
このたび、新たに製造販売するレナリドミドカプセルは、サリドマイドの誘導体を主成分と
していることから、サレドカプセルとレナリドミドカプセルの両方を厳格に管理し、医療現場
及び患者の負担を軽減するようサリドマイド製剤等安全管理手順(TERMS®)に改訂した。
2.目的
本手順は、藤本製薬株式会社が製造販売承認を受けたサレドカプセル、レナリドミドカプセ
ル(以下、
「サリドマイド製剤等」という)を厳格に管理し、併せてこの厳格な管理を基盤とし
たサリドマイド製剤等の適正な使用を推進し、サリドマイド製剤等の胎児への曝露を防止する
ことを目的とする。
1