よむ、つかう、まなぶ。
参考資料1-2 TERMS®サリドマイド製剤等安全管理手順[6.2MB] (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40908.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第3回 6/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
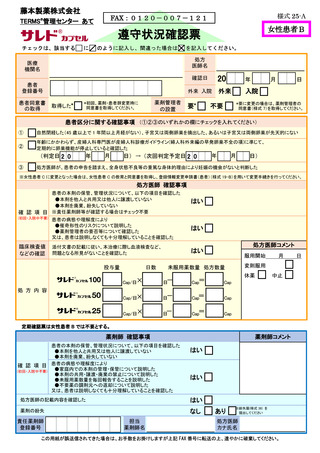
8.3.2.血液検査等
すべての患者に対し、定期的に血液検査等を実施し、血液毒性等の発現に注意する。
8.4.禁止事項
8.4.1.禁止項目及び禁止期間
サリドマイド製剤等による治療中(休薬期間中も含む)の患者の禁止項目及び禁止期
間は、以下のとおりとする。
【患者共通】
・サリドマイド製剤等の脱カプセル
・サリドマイド製剤等の共用、譲渡及び廃棄
・献血
【男性患者】
・コンドームを使用しない性交渉:
サリドマイド製剤等服用開始時から服用中止 4 週間後まで
・精子、精液の提供
:サリドマイド製剤等服用開始時から服用中止 4 週間後まで
・妊婦との性交渉
:サリドマイド製剤等服用開始時から服用中止 4 週間後まで
【女性患者 C】
:サリドマイド製剤等服用開始時から服用中止 4 週間後まで
・授乳
・避妊を実施しない性交渉:
サリドマイド製剤等服用開始 4 週間前から服用中止 4 週間
後まで
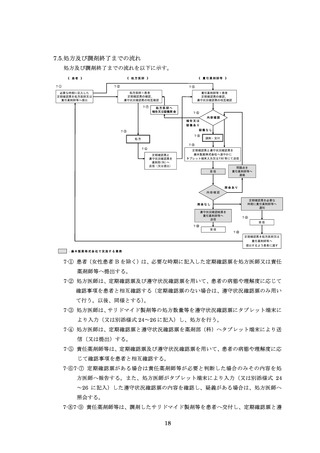
8.4.2.禁止項目の遵守状況確認
【サリドマイド製剤等服用開始時から服用中止時まで】
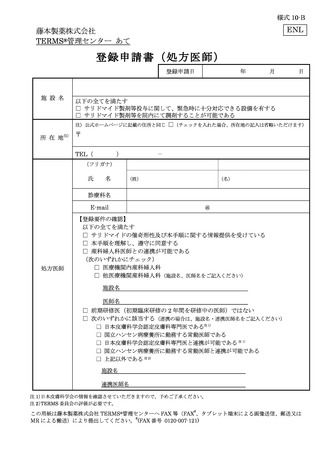
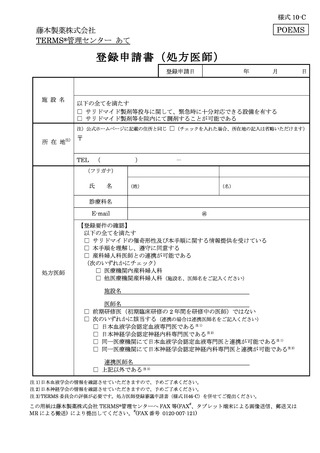
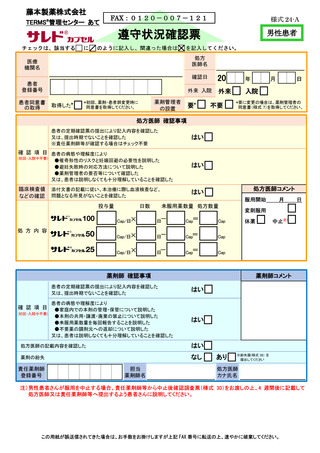
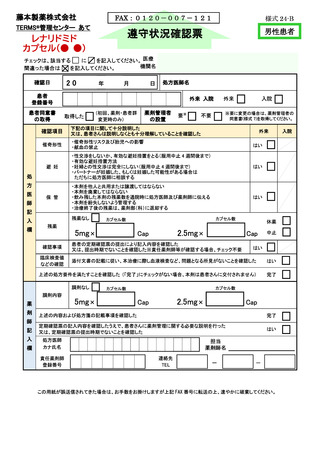
処方医師及び責任薬剤師等は、定期確認票及び遵守状況確認票を用いて患者の禁止
項目の遵守状況を確認する(詳細は 7.2.~7.4.を参照)。
【サリドマイド製剤等服用中止から服用中止 4 週間後まで】(女性患者 B を除く)
【サレドカプセルの場合(レナリドミドカプセルを除く)】
・男性患者の場合
責任薬剤師等は、男性患者がサレドカプセルの服用を中止する場合に、中止後
確認調査票(別添様式 30)を患者に渡し、4 週間後に禁止項目の遵守状況を記入
の上、処方医師又は責任薬剤師等に提出するよう依頼する。責任薬剤師等へ提出
された場合は責任薬剤師等が必要と判断した場合のみその内容を処方医師へ報告
する。責任薬剤師等は、その結果を藤本製薬株式会社へ FAX 等により送信する。
藤本製薬株式会社は、禁止項目が遵守されていることを確認し、受取通知を責
任薬剤師等に FAX する。
24
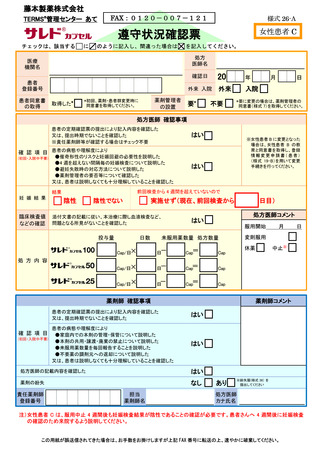
すべての患者に対し、定期的に血液検査等を実施し、血液毒性等の発現に注意する。
8.4.禁止事項
8.4.1.禁止項目及び禁止期間
サリドマイド製剤等による治療中(休薬期間中も含む)の患者の禁止項目及び禁止期
間は、以下のとおりとする。
【患者共通】
・サリドマイド製剤等の脱カプセル
・サリドマイド製剤等の共用、譲渡及び廃棄
・献血
【男性患者】
・コンドームを使用しない性交渉:
サリドマイド製剤等服用開始時から服用中止 4 週間後まで
・精子、精液の提供
:サリドマイド製剤等服用開始時から服用中止 4 週間後まで
・妊婦との性交渉
:サリドマイド製剤等服用開始時から服用中止 4 週間後まで
【女性患者 C】
:サリドマイド製剤等服用開始時から服用中止 4 週間後まで
・授乳
・避妊を実施しない性交渉:
サリドマイド製剤等服用開始 4 週間前から服用中止 4 週間
後まで
8.4.2.禁止項目の遵守状況確認
【サリドマイド製剤等服用開始時から服用中止時まで】
処方医師及び責任薬剤師等は、定期確認票及び遵守状況確認票を用いて患者の禁止
項目の遵守状況を確認する(詳細は 7.2.~7.4.を参照)。
【サリドマイド製剤等服用中止から服用中止 4 週間後まで】(女性患者 B を除く)
【サレドカプセルの場合(レナリドミドカプセルを除く)】
・男性患者の場合
責任薬剤師等は、男性患者がサレドカプセルの服用を中止する場合に、中止後
確認調査票(別添様式 30)を患者に渡し、4 週間後に禁止項目の遵守状況を記入
の上、処方医師又は責任薬剤師等に提出するよう依頼する。責任薬剤師等へ提出
された場合は責任薬剤師等が必要と判断した場合のみその内容を処方医師へ報告
する。責任薬剤師等は、その結果を藤本製薬株式会社へ FAX 等により送信する。
藤本製薬株式会社は、禁止項目が遵守されていることを確認し、受取通知を責
任薬剤師等に FAX する。
24