よむ、つかう、まなぶ。
参考資料1-2 TERMS®サリドマイド製剤等安全管理手順[6.2MB] (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40908.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第3回 6/25)《厚生労働省》 |
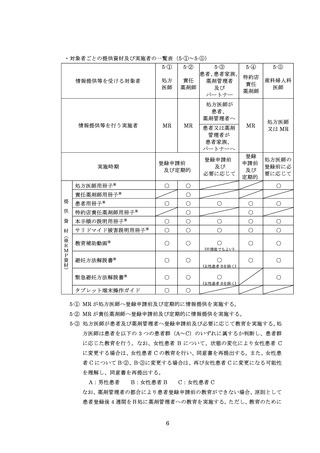
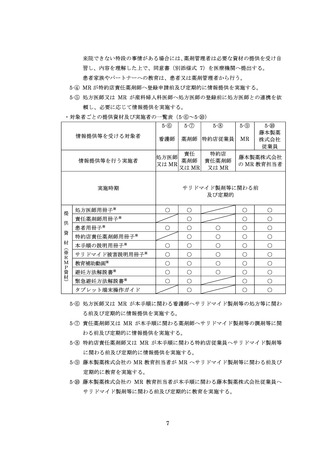
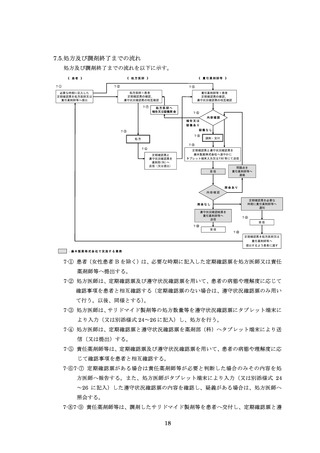
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
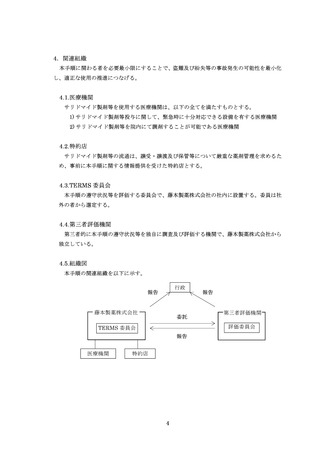
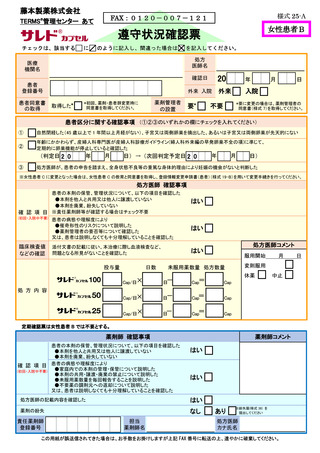
様式 19-B
藤本製薬株式会社
TERMS®管理センター あて
登録情報変更申請書(患者)
申請日:
年
月
日
処方医師名
施設名
患者生年月日
患者群
大・昭・平・令・西暦
年
月
患者登録番号
日
【変更内容】変更箇所にチェック及び変更内容をご記入ください。
□A:男性患者
□B:女性患者 B
い
ず
れ
か
に
チ
ェ
ッ
ク
患
者
群
□B-①
□B-②
□B-③
医療機関名(
)
産婦人科専門医名(
)
重篤な身体的理由(
)
※1)
□C:女性患者 C
服用開始予定 4 週間前及び 2 週間前注)の妊娠検査が陰性であった、又は同意日の
4 週間前から性交渉をしていないことを確認した
2 週間前の妊娠検査はサレドカプセルのみ実施
注)
□ MM
疾 患
名
□ ENL 注 1)
□ POEMS 注 1)
注 1)
サレドカプセルのみ
□ その他(疾患名
)
薬剤管理者の設置
□要 ※2)
□不要
第三者評価機関の調査
□できる
□できない(電話調査ができない場合は記入調査となります)
□ その他の変更
※1)患者群を変更する場合は患者の同意書(様式 4~6 のいずれか)を取得してください。
※2)要の場合は薬剤管理者の同意書(様式 7)を取得してください。
※
※
※
変更内容が医療機関の有している患者及び薬剤管理者の情報(氏名、住所、電話番号等)の場合は、藤本製薬株式
会社への届出は不要です。
FAX#、郵送又は MR 搬送による申請の場合は、この用紙を藤本製薬株式会社 TERMS®管理センターへ提出して
ください。#(FAX 番号 0120-007-121)
登録変更完了後に、藤本製薬株式会社より「登録情報変更通知書(患者)
」
(様式 20-B)をお送りします。
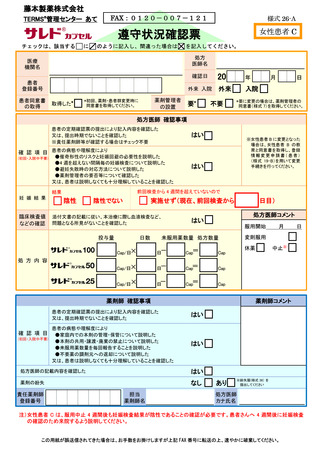
藤本製薬株式会社
TERMS®管理センター あて
登録情報変更申請書(患者)
申請日:
年
月
日
処方医師名
施設名
患者生年月日
患者群
大・昭・平・令・西暦
年
月
患者登録番号
日
【変更内容】変更箇所にチェック及び変更内容をご記入ください。
□A:男性患者
□B:女性患者 B
い
ず
れ
か
に
チ
ェ
ッ
ク
患
者
群
□B-①
□B-②
□B-③
医療機関名(
)
産婦人科専門医名(
)
重篤な身体的理由(
)
※1)
□C:女性患者 C
服用開始予定 4 週間前及び 2 週間前注)の妊娠検査が陰性であった、又は同意日の
4 週間前から性交渉をしていないことを確認した
2 週間前の妊娠検査はサレドカプセルのみ実施
注)
□ MM
疾 患
名
□ ENL 注 1)
□ POEMS 注 1)
注 1)
サレドカプセルのみ
□ その他(疾患名
)
薬剤管理者の設置
□要 ※2)
□不要
第三者評価機関の調査
□できる
□できない(電話調査ができない場合は記入調査となります)
□ その他の変更
※1)患者群を変更する場合は患者の同意書(様式 4~6 のいずれか)を取得してください。
※2)要の場合は薬剤管理者の同意書(様式 7)を取得してください。
※
※
※
変更内容が医療機関の有している患者及び薬剤管理者の情報(氏名、住所、電話番号等)の場合は、藤本製薬株式
会社への届出は不要です。
FAX#、郵送又は MR 搬送による申請の場合は、この用紙を藤本製薬株式会社 TERMS®管理センターへ提出して
ください。#(FAX 番号 0120-007-121)
登録変更完了後に、藤本製薬株式会社より「登録情報変更通知書(患者)
」
(様式 20-B)をお送りします。