よむ、つかう、まなぶ。
参考資料1-2 TERMS®サリドマイド製剤等安全管理手順[6.2MB] (66 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40908.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第3回 6/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
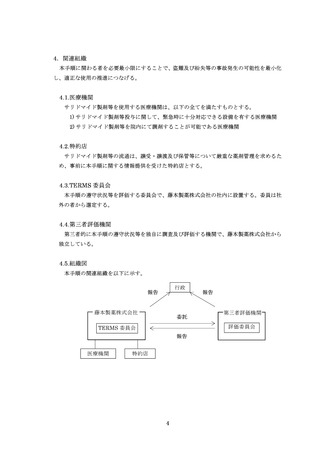
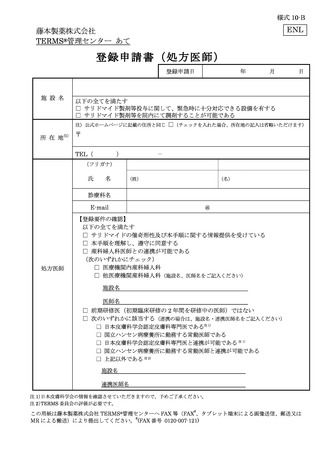
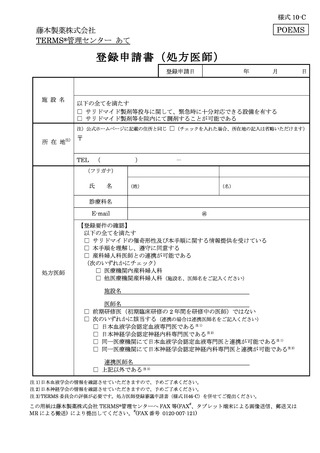
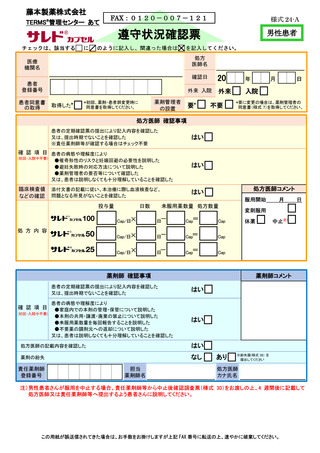
藤本製薬株式会社
FAX:0120-007-121
TERMS®管理センター あて
様式 25-B
遵守状況確認票
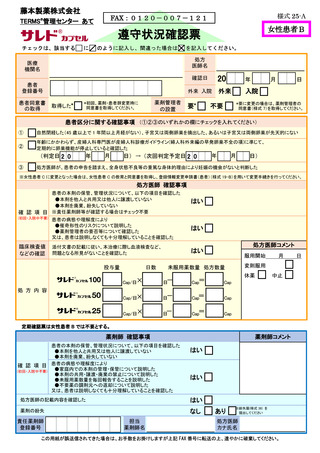
レナリドミド
カプセル(● ●)
女性患者B
チェックは、該当する
に
を記入してください。 医療
間違った場合は
を記入してください。
機関名
20
確認日
年
月
日
処方医師名
患者
登録番号
患者同意書
の取得
外来 入院
患者区分の
確認
年齢にかかわらず、産婦人科専門医が産婦人科診療ガイドライン(婦人科外来編の早発卵巣不全の
項)に準じて、定期的に卵巣機能が停止していると確認した
今回
判定日
確認事項
③
年
月
はい
・本剤を他人と共用又は譲渡してはならない
・本剤を廃棄してはならない
・飲み残した本剤の残薬数を通院時に処方医師及び薬剤師に伝える
・本剤を紛失しないよう管理する
・治療終了後の残薬は、薬剤部(科)に返却する
はい
保 管
日
外来
カプセル数
カプセル数
5mg×
2.5mg×
Cap
休薬
Cap
中止
添付文書の記載に従い、本治療に際し血液検査など、問題となる所見がないことを確認した
はい
上述の処方要件を満たすことを確認した (「完了」にチェックがない場合、本剤は患者さんに交付されません)
完了
調剤なし
調剤内容
薬
欄
20
・催奇形性リスク及び胎児への影響
・献血の禁止
臨床検査値
などの確認
入
次回
判定日
催奇形性
残 薬
記
日
処方医師が、患者の申告を踏まえ、全身状態不良等の重篤な身体的理由により妊娠の機会がない
と判断した
残薬なし
師
月
下記の項目に関して十分説明した
又は、患者さんは説明しなくとも十分理解していることを確認した
入
剤
年
確認項目
師
欄
20
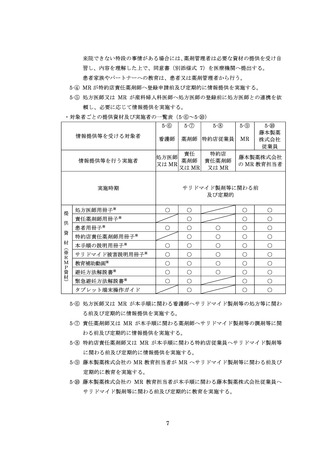
※女性患者 C に変更となった場合は、女性患者 C の教育と同意書を取得し、登録情報変更申請書(患者)
(様式 19-B)を用いて変更手続きを行ってください
方
記
※要に変更の場合は、薬剤管理者の
同意書(様式 7)を取得してください。
不要
自然閉経した(45 歳以上で 1 年間以上月経がない)、子宮又は両側卵巣を摘出した、
あるいは子宮又は両側卵巣が先天的にない
②
医
要※
入院
(①②③のいずれかの欄にチェックを入れてください)
①
処
薬剤管理者
の設置
(初回、薬剤・患者群
変更時のみ)
取得した
外来
カプセル数
カプセル数
5mg×
2.5mg×
Cap
Cap
上述の内容及び処方箋の記載事項を確認した
完了
患者さんに薬剤に関する必要な説明を行った
はい
担当
薬剤師名
処方医師
カナ氏名
責任薬剤師
登録番号
連絡先
TEL
-
-
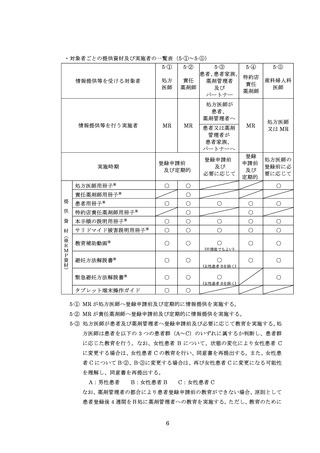
※定期確認票は女性患者 B では不要とする
この用紙が誤送信されてきた場合は、お手数をお掛けしますが上記 FAX 番号に転送の上、速やかに破棄してください。
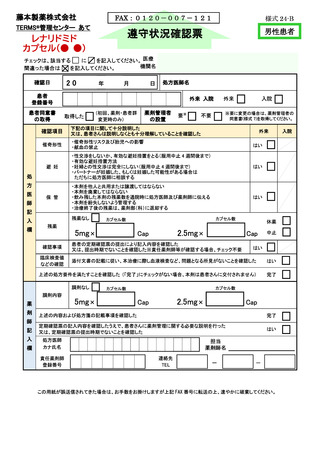
入院
FAX:0120-007-121
TERMS®管理センター あて
様式 25-B
遵守状況確認票
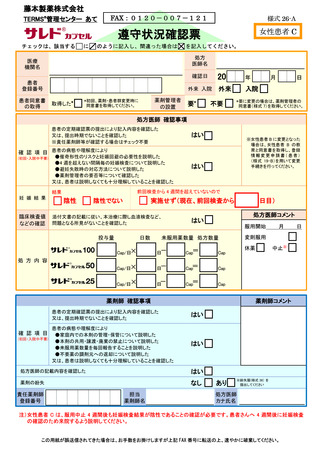
レナリドミド
カプセル(● ●)
女性患者B
チェックは、該当する
に
を記入してください。 医療
間違った場合は
を記入してください。
機関名
20
確認日
年
月
日
処方医師名
患者
登録番号
患者同意書
の取得
外来 入院
患者区分の
確認
年齢にかかわらず、産婦人科専門医が産婦人科診療ガイドライン(婦人科外来編の早発卵巣不全の
項)に準じて、定期的に卵巣機能が停止していると確認した
今回
判定日
確認事項
③
年
月
はい
・本剤を他人と共用又は譲渡してはならない
・本剤を廃棄してはならない
・飲み残した本剤の残薬数を通院時に処方医師及び薬剤師に伝える
・本剤を紛失しないよう管理する
・治療終了後の残薬は、薬剤部(科)に返却する
はい
保 管
日
外来
カプセル数
カプセル数
5mg×
2.5mg×
Cap
休薬
Cap
中止
添付文書の記載に従い、本治療に際し血液検査など、問題となる所見がないことを確認した
はい
上述の処方要件を満たすことを確認した (「完了」にチェックがない場合、本剤は患者さんに交付されません)
完了
調剤なし
調剤内容
薬
欄
20
・催奇形性リスク及び胎児への影響
・献血の禁止
臨床検査値
などの確認
入
次回
判定日
催奇形性
残 薬
記
日
処方医師が、患者の申告を踏まえ、全身状態不良等の重篤な身体的理由により妊娠の機会がない
と判断した
残薬なし
師
月
下記の項目に関して十分説明した
又は、患者さんは説明しなくとも十分理解していることを確認した
入
剤
年
確認項目
師
欄
20
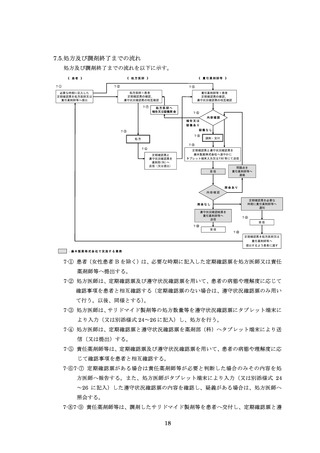
※女性患者 C に変更となった場合は、女性患者 C の教育と同意書を取得し、登録情報変更申請書(患者)
(様式 19-B)を用いて変更手続きを行ってください
方
記
※要に変更の場合は、薬剤管理者の
同意書(様式 7)を取得してください。
不要
自然閉経した(45 歳以上で 1 年間以上月経がない)、子宮又は両側卵巣を摘出した、
あるいは子宮又は両側卵巣が先天的にない
②
医
要※
入院
(①②③のいずれかの欄にチェックを入れてください)
①
処
薬剤管理者
の設置
(初回、薬剤・患者群
変更時のみ)
取得した
外来
カプセル数
カプセル数
5mg×
2.5mg×
Cap
Cap
上述の内容及び処方箋の記載事項を確認した
完了
患者さんに薬剤に関する必要な説明を行った
はい
担当
薬剤師名
処方医師
カナ氏名
責任薬剤師
登録番号
連絡先
TEL
-
-
※定期確認票は女性患者 B では不要とする
この用紙が誤送信されてきた場合は、お手数をお掛けしますが上記 FAX 番号に転送の上、速やかに破棄してください。
入院