よむ、つかう、まなぶ。
参考資料1-2 TERMS®サリドマイド製剤等安全管理手順[6.2MB] (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40908.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第3回 6/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
TERMS®
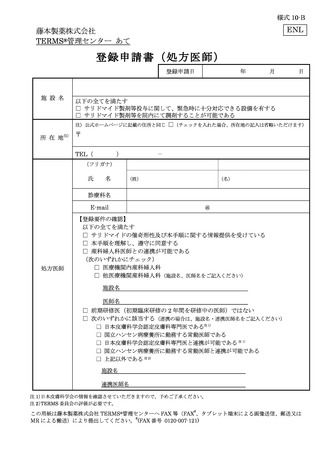
様式 6
サレドカプセル・レナリドミドカプセル「● ●」治療に関する同意書
投与予定薬剤
□ サレドカプセル
□ レナリドミドカプセル「● ●」
女性患者
C
.
あなたの病気の治療のために、上記にて選択したサレドカプセル、レナリドミドカプセル「● ●」(以下、「本剤」という)が使用されます。
本剤を適切に使用していただくために、「サリドマイド製剤等安全管理手順」(TERMSⓇ)の内容を理解し、同意される項目に☑を記入
してください。
なお、あなたの日常生活に当てはまらない項目が含まれているかもしれませんが、すべての女性患者 C を対象としておりますのでご了承
ください。
患
者
さ
ん
情
報
の
取
り
扱
い
に
つ
い
て
□ 私の生年月日、疾患名、患者群等の情報(以下、「TERMS 情報※2」という)が、処方医師から藤本製薬株式会社に登録されることに
同意します。
□ TERMS 情報の利用目的が、藤本製薬株式会社の製造販売する本剤の安全かつ適切な処方、服用、廃棄の管理にあることについて
理解しました。
□ また、TERMS®の運用に問題(TERMS®からの逸脱、薬剤の紛失や誤投与など)があった場合、それを改善する目的に必要な範囲で、
TERMS 情報が、藤本製薬株式会社から TERMS 委員会※3、第三者評価機関に提供されることに同意します。
□ さらに、私自身の妊娠が確認された等の胎児に障害を及ぼすような重大な逸脱があった場合の追跡調査に際して、医療機関が
必要と認めた場合に、私の医療機関登録情報(氏名、住所及び電話番号)が、医療機関から藤本製薬株式会社に提供されることに
同意します。
□ 転院先で継続して本剤の処方を受ける場合は、藤本製薬株式会社から転院先へ転院元の TERMS 情報が提供されることに同意
します。
□ 転院先で継続して本剤の処方を受ける場合は、転院先より藤本製薬株式会社に私の TERMS 情報及び医療機関登録情報が提供
されることに同意します。
□ 藤本製薬株式会社の担当者が医療機関における TERMS の保管記録を確認する際に、私の個人名の記載がある同意書を見ることが
あることを承諾します。その場合、守秘義務があり、他に漏れることがないことを理解します。
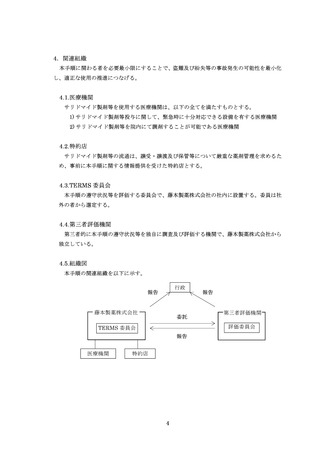
※1:第三者評価機関とは、第三者的に TERMS の遵守状況等を独自に調査及び評価する機関で、患者や医療関係者へアンケート調査を実施
して、必要な改善点について提言を行います。医学・薬学の有識者、人文・社会科学の有識者、患者及び薬害被害者の意見を反映できる
者等から構成される評価委員会を有します。評価委員会には、オブザーバーとして厚生労働省が参加しています。
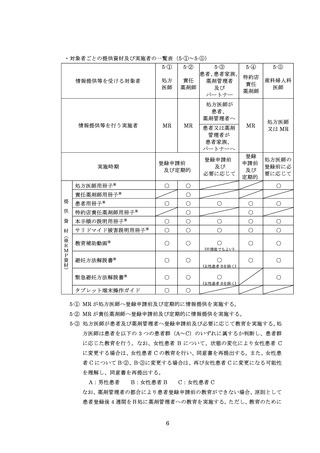
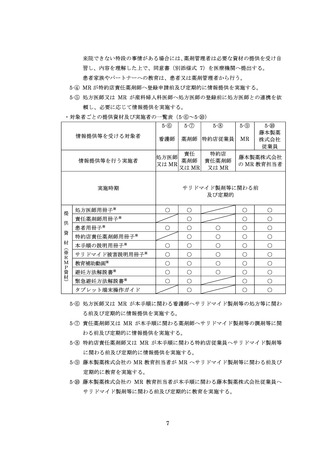
※2:TERMS 情報には、患者の生年月日、患者群、疾患名、登録要件の適合状況、登録申請日、登録日、登録番号、第三者評価機関に対する電
話アンケートの回答の可否、薬剤管理者設置の有無、登録申請医師名、処方日・処方薬剤・処方医師名・遵守状況の確認・処方内容(残
数・調剤内容)、患者同意書の取得、定期確認票の記入日及び確認内容(女性患者 B は除く)、中止後確認調査票の記入日及び確認内容
(サレドカプセルのみ、女性患者 B は除く)、不要薬返却者・返却日・数量・返却理由、変更申請日・変更内容が含まれます。
※3:TERMS 委員会とは、TERMS の遵守状況等を評価するために必要な知識及び経験を有する社外の弁護士・医師・薬剤師により構成される
委員会で、TERMS の遵守状況等を評価します。
【患者記入欄】
同意日:
年
月
日
患者署名:
患者本人の署名を基本としますが、本人の署名又は同意が病状等で困難な場合に限り代筆者又は代諾者の署名をお願いします。
代筆者又は代諾者氏名:
【処方医師記入欄】
処方医師名:
1 枚目は医療機関にて保存し、2 枚目は患者さんにお渡しください。
(続柄
)
サレドカプセル・レナリドミドカプセル「● ●」治療に関する同意書
T
E
R
M
S
に
つ
い
て
□ 本剤の胎児に対する危険性の説明を受け、理解しました。
□ 本剤を女性が服用して妊娠した場合、あるいは妊娠している女性が服用した場合、胎児に障害が現れる可能性があることを理解
しました。
□ 有効な避妊法の必要性(性交渉をしないか、又は適切な避妊法の実施)について詳細な説明を受け、了解しました。
□ 本剤服用開始 4 週間前から服用中止 4 週間後まで、
①性交渉をしないか、
②パートナーとともに定められた避妊法を実施する必要がある
ことを了解しました。これは、私が無月経でも該当します。
□ 妊娠反応検査を服用開始 4 週間前・2 週間前(必要な場合)、初回処方前(処方開始 3 日前から直前)、本剤による治療中(休薬期間を
含む)は 4 週間を超えない間隔ごと、服用中止時、服用中止 4 週間後に行う必要があること、同時に避妊状況の確認が行われることを
了解しました。服用開始 2 週間前の検査はサレドカプセルのみ実施。
□ 本剤による治療中に妊娠の疑いが生じた場合は、直ちに本剤の服用を中止し、本剤を処方する医師(以下、「処方医師」という)に
報告します。万が一、妊娠した場合は追跡調査に協力します。
□ 本剤による治療中(休薬期間を含む)ならびに本剤服用中止 4 週間後まで授乳を行いません。
□ 献血をしません。
□ 本剤は、私のみが服用し、第三者に譲渡しません。また、本剤を子供の手の届かない自分専用の場所で、飲食物と区別して保管
します。
□ 本剤による治療中、飲み残した本剤があれば、通院時に処方医師及び薬剤師に残薬数を伝えます。
□ 本剤を紛失した場合は、本剤を受け取った薬剤部(科)へ直ちに連絡し薬剤師の指示に従います。
□ 使用する予定がない本剤を薬剤部(科)に返却すること、またその際には返金がないことを了解しました。
□ 妊娠回避の不徹底、また本剤を不適切に扱ったことにより事故が生じた場合には、私自身にも責任があることを了解しました。
□ 安全管理手順から逸脱した場合、その内容によっては、本剤服用の一時停止、又は本剤での治療が中止されることを承諾します。
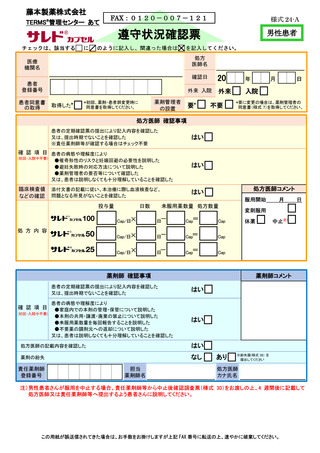
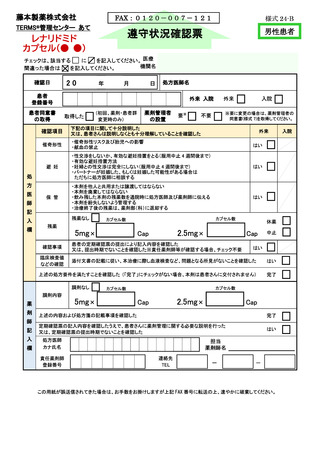
□ 定期的に実施される「定期確認票」を必ず提出します。
□ 第三者評価機関※1 が行うアンケート調査に協力します。
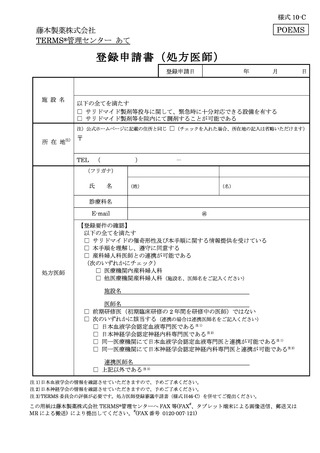
様式 6
サレドカプセル・レナリドミドカプセル「● ●」治療に関する同意書
投与予定薬剤
□ サレドカプセル
□ レナリドミドカプセル「● ●」
女性患者
C
.
あなたの病気の治療のために、上記にて選択したサレドカプセル、レナリドミドカプセル「● ●」(以下、「本剤」という)が使用されます。
本剤を適切に使用していただくために、「サリドマイド製剤等安全管理手順」(TERMSⓇ)の内容を理解し、同意される項目に☑を記入
してください。
なお、あなたの日常生活に当てはまらない項目が含まれているかもしれませんが、すべての女性患者 C を対象としておりますのでご了承
ください。
患
者
さ
ん
情
報
の
取
り
扱
い
に
つ
い
て
□ 私の生年月日、疾患名、患者群等の情報(以下、「TERMS 情報※2」という)が、処方医師から藤本製薬株式会社に登録されることに
同意します。
□ TERMS 情報の利用目的が、藤本製薬株式会社の製造販売する本剤の安全かつ適切な処方、服用、廃棄の管理にあることについて
理解しました。
□ また、TERMS®の運用に問題(TERMS®からの逸脱、薬剤の紛失や誤投与など)があった場合、それを改善する目的に必要な範囲で、
TERMS 情報が、藤本製薬株式会社から TERMS 委員会※3、第三者評価機関に提供されることに同意します。
□ さらに、私自身の妊娠が確認された等の胎児に障害を及ぼすような重大な逸脱があった場合の追跡調査に際して、医療機関が
必要と認めた場合に、私の医療機関登録情報(氏名、住所及び電話番号)が、医療機関から藤本製薬株式会社に提供されることに
同意します。
□ 転院先で継続して本剤の処方を受ける場合は、藤本製薬株式会社から転院先へ転院元の TERMS 情報が提供されることに同意
します。
□ 転院先で継続して本剤の処方を受ける場合は、転院先より藤本製薬株式会社に私の TERMS 情報及び医療機関登録情報が提供
されることに同意します。
□ 藤本製薬株式会社の担当者が医療機関における TERMS の保管記録を確認する際に、私の個人名の記載がある同意書を見ることが
あることを承諾します。その場合、守秘義務があり、他に漏れることがないことを理解します。
※1:第三者評価機関とは、第三者的に TERMS の遵守状況等を独自に調査及び評価する機関で、患者や医療関係者へアンケート調査を実施
して、必要な改善点について提言を行います。医学・薬学の有識者、人文・社会科学の有識者、患者及び薬害被害者の意見を反映できる
者等から構成される評価委員会を有します。評価委員会には、オブザーバーとして厚生労働省が参加しています。
※2:TERMS 情報には、患者の生年月日、患者群、疾患名、登録要件の適合状況、登録申請日、登録日、登録番号、第三者評価機関に対する電
話アンケートの回答の可否、薬剤管理者設置の有無、登録申請医師名、処方日・処方薬剤・処方医師名・遵守状況の確認・処方内容(残
数・調剤内容)、患者同意書の取得、定期確認票の記入日及び確認内容(女性患者 B は除く)、中止後確認調査票の記入日及び確認内容
(サレドカプセルのみ、女性患者 B は除く)、不要薬返却者・返却日・数量・返却理由、変更申請日・変更内容が含まれます。
※3:TERMS 委員会とは、TERMS の遵守状況等を評価するために必要な知識及び経験を有する社外の弁護士・医師・薬剤師により構成される
委員会で、TERMS の遵守状況等を評価します。
【患者記入欄】
同意日:
年
月
日
患者署名:
患者本人の署名を基本としますが、本人の署名又は同意が病状等で困難な場合に限り代筆者又は代諾者の署名をお願いします。
代筆者又は代諾者氏名:
【処方医師記入欄】
処方医師名:
1 枚目は医療機関にて保存し、2 枚目は患者さんにお渡しください。
(続柄
)
サレドカプセル・レナリドミドカプセル「● ●」治療に関する同意書
T
E
R
M
S
に
つ
い
て
□ 本剤の胎児に対する危険性の説明を受け、理解しました。
□ 本剤を女性が服用して妊娠した場合、あるいは妊娠している女性が服用した場合、胎児に障害が現れる可能性があることを理解
しました。
□ 有効な避妊法の必要性(性交渉をしないか、又は適切な避妊法の実施)について詳細な説明を受け、了解しました。
□ 本剤服用開始 4 週間前から服用中止 4 週間後まで、
①性交渉をしないか、
②パートナーとともに定められた避妊法を実施する必要がある
ことを了解しました。これは、私が無月経でも該当します。
□ 妊娠反応検査を服用開始 4 週間前・2 週間前(必要な場合)、初回処方前(処方開始 3 日前から直前)、本剤による治療中(休薬期間を
含む)は 4 週間を超えない間隔ごと、服用中止時、服用中止 4 週間後に行う必要があること、同時に避妊状況の確認が行われることを
了解しました。服用開始 2 週間前の検査はサレドカプセルのみ実施。
□ 本剤による治療中に妊娠の疑いが生じた場合は、直ちに本剤の服用を中止し、本剤を処方する医師(以下、「処方医師」という)に
報告します。万が一、妊娠した場合は追跡調査に協力します。
□ 本剤による治療中(休薬期間を含む)ならびに本剤服用中止 4 週間後まで授乳を行いません。
□ 献血をしません。
□ 本剤は、私のみが服用し、第三者に譲渡しません。また、本剤を子供の手の届かない自分専用の場所で、飲食物と区別して保管
します。
□ 本剤による治療中、飲み残した本剤があれば、通院時に処方医師及び薬剤師に残薬数を伝えます。
□ 本剤を紛失した場合は、本剤を受け取った薬剤部(科)へ直ちに連絡し薬剤師の指示に従います。
□ 使用する予定がない本剤を薬剤部(科)に返却すること、またその際には返金がないことを了解しました。
□ 妊娠回避の不徹底、また本剤を不適切に扱ったことにより事故が生じた場合には、私自身にも責任があることを了解しました。
□ 安全管理手順から逸脱した場合、その内容によっては、本剤服用の一時停止、又は本剤での治療が中止されることを承諾します。
□ 定期的に実施される「定期確認票」を必ず提出します。
□ 第三者評価機関※1 が行うアンケート調査に協力します。