よむ、つかう、まなぶ。
参考資料1-2 TERMS®サリドマイド製剤等安全管理手順[6.2MB] (73 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40908.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第3回 6/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
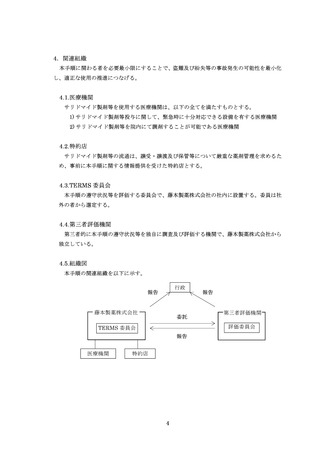
様式 37-B
藤本製薬株式会社
TERMS®管理センター あて
記入日
年
月
日
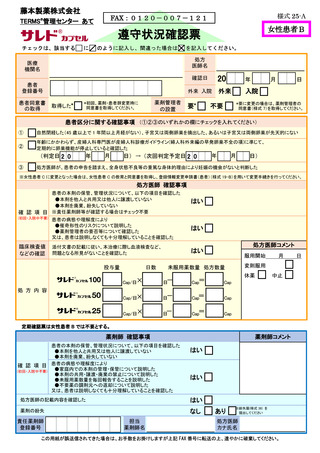
サリドマイド製剤等不要薬受領書
施設名
責任薬剤師登録番号
□患者本人
不要薬返却者
□その他(
)
患者登録番号
不要薬受領日
年
月
日
該当するものにチェックのうえ数量をご記入ください
不要薬数量
□ サレドカプセル
100 mg ×
カプセル
□ サレドカプセル
50 mg ×
カプセル
□ サレドカプセル
25 mg ×
カプセル
□ レナリドミドカプセル
5 mg ×
カプセル
□ レナリドミドカプセル
2.5mg ×
カプセル
□本剤服用中止
不要となった
理由
廃棄方法
□その他
(
□藤本製薬回収廃棄
)
注 1)
□医療機関廃棄
注 2)
注 1)不要薬を藤本製薬で廃棄の場合、この用紙と不要薬を MR へお渡しください。
#
注 2)不要薬を医療機関で廃棄の場合、この用紙を藤本製薬株式会社 TERMS®管理センターへ FAX 等(FAX 、
タブレット端末による画像送信、郵送又は MR による搬送)により提出してください。
#
(FAX 番号 0120-007-121)
【 藤本製薬 MR 記入欄 】
不要薬受領者
不要薬受領日
年
月
日
藤本製薬株式会社
TERMS®管理センター あて
記入日
年
月
日
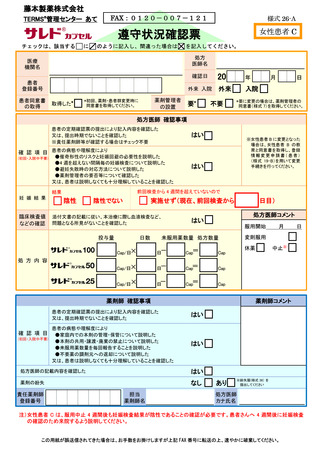
サリドマイド製剤等不要薬受領書
施設名
責任薬剤師登録番号
□患者本人
不要薬返却者
□その他(
)
患者登録番号
不要薬受領日
年
月
日
該当するものにチェックのうえ数量をご記入ください
不要薬数量
□ サレドカプセル
100 mg ×
カプセル
□ サレドカプセル
50 mg ×
カプセル
□ サレドカプセル
25 mg ×
カプセル
□ レナリドミドカプセル
5 mg ×
カプセル
□ レナリドミドカプセル
2.5mg ×
カプセル
□本剤服用中止
不要となった
理由
廃棄方法
□その他
(
□藤本製薬回収廃棄
)
注 1)
□医療機関廃棄
注 2)
注 1)不要薬を藤本製薬で廃棄の場合、この用紙と不要薬を MR へお渡しください。
#
注 2)不要薬を医療機関で廃棄の場合、この用紙を藤本製薬株式会社 TERMS®管理センターへ FAX 等(FAX 、
タブレット端末による画像送信、郵送又は MR による搬送)により提出してください。
#
(FAX 番号 0120-007-121)
【 藤本製薬 MR 記入欄 】
不要薬受領者
不要薬受領日
年
月
日