よむ、つかう、まなぶ。
最終とりまとめ (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41063.html |
| 出典情報 | ヘルスケアスタートアップ等の振興・支援策検討プロジェクトチーム 最終とりまとめの公表について(6/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
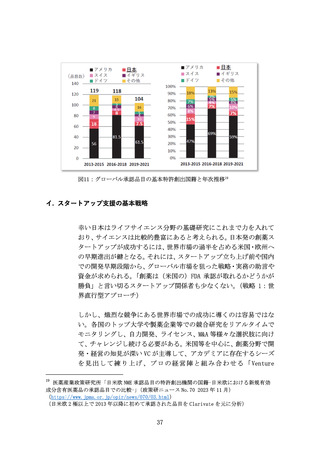
携しながら、インパクト創出のマーケットに関わる多様な参加者間
のネットワーク形成や事例・ノウハウ共有の促進策を検討する。
上市までの時間・コストの大幅圧縮に向けて、分散型臨床試験(DCT)
等の治験DXを積極導入する
(ア) 問題の所在
ヘルスケアスタートアップ発の医薬品・医療機器・SaMDの上市を促進
するためには、治験に要するコスト・時間が不必要に嵩まないことが
必要であるところ、日本においては、他国と比較して、治験参加施設
数が多い中で各施設での治験実施状況のモニタリング等が非効率で
あり、かつ各施設における倫理審査に要する時間が長い等、治験が高
コスト・長期間になる傾向があり、国際共同治験に日本が含まれない
理由の一つとなっているとの批判がある11。例えば、分散型臨床試験
(DCT)を推進することで、ウェアラブルデバイスの活用や、地方の
病院と治験を統括する病院のオンライン連携等により、地方にいな
がらにして遠隔地での治験に参加できるようになれば、治験参加者
のリクルーティングに要する時間を短縮できることも期待し得ると
ころ、DCTには更なる普及の余地がある。また、治験審査委員会の中
央化(いわゆる中央IRB)は、制度上は可能であるものの、実務上必
ずしも進展していない他、治験審査委員会が中央化されていたとし
ても別途各施設の長の承認が求められる等、国の施策の趣旨が実務
に浸透していないとの指摘がある。
(イ) 提言
治験に関する諸業務のDXを推進することによって、治験を効率化す
る。特に、DCTの積極的な活用を促進するために必要な施策を講じる。
11
例えば、PhRMA/EFPIA Japan 共催セミナー「第 23 回 CRC と臨床試験のあり方を考える会議
2023」資料(https://www.phrma-jp.org/wordpress/wpcontent/uploads/2023/10/phrma_efpiajapan_seminar2023-01.pdf)
27
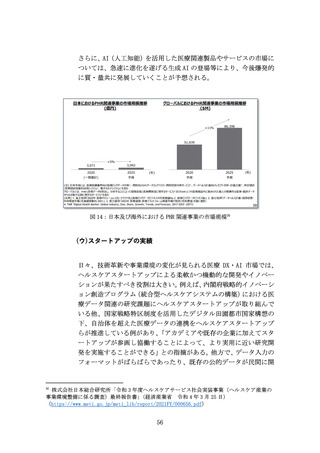
のネットワーク形成や事例・ノウハウ共有の促進策を検討する。
上市までの時間・コストの大幅圧縮に向けて、分散型臨床試験(DCT)
等の治験DXを積極導入する
(ア) 問題の所在
ヘルスケアスタートアップ発の医薬品・医療機器・SaMDの上市を促進
するためには、治験に要するコスト・時間が不必要に嵩まないことが
必要であるところ、日本においては、他国と比較して、治験参加施設
数が多い中で各施設での治験実施状況のモニタリング等が非効率で
あり、かつ各施設における倫理審査に要する時間が長い等、治験が高
コスト・長期間になる傾向があり、国際共同治験に日本が含まれない
理由の一つとなっているとの批判がある11。例えば、分散型臨床試験
(DCT)を推進することで、ウェアラブルデバイスの活用や、地方の
病院と治験を統括する病院のオンライン連携等により、地方にいな
がらにして遠隔地での治験に参加できるようになれば、治験参加者
のリクルーティングに要する時間を短縮できることも期待し得ると
ころ、DCTには更なる普及の余地がある。また、治験審査委員会の中
央化(いわゆる中央IRB)は、制度上は可能であるものの、実務上必
ずしも進展していない他、治験審査委員会が中央化されていたとし
ても別途各施設の長の承認が求められる等、国の施策の趣旨が実務
に浸透していないとの指摘がある。
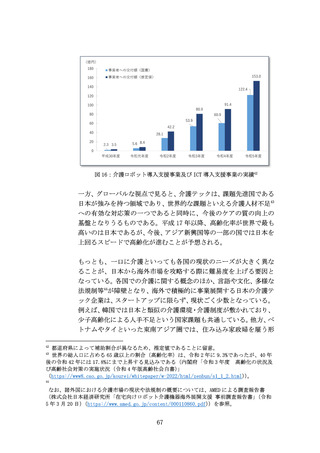
(イ) 提言
治験に関する諸業務のDXを推進することによって、治験を効率化す
る。特に、DCTの積極的な活用を促進するために必要な施策を講じる。
11
例えば、PhRMA/EFPIA Japan 共催セミナー「第 23 回 CRC と臨床試験のあり方を考える会議
2023」資料(https://www.phrma-jp.org/wordpress/wpcontent/uploads/2023/10/phrma_efpiajapan_seminar2023-01.pdf)
27