よむ、つかう、まなぶ。
最終とりまとめ (47 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41063.html |
| 出典情報 | ヘルスケアスタートアップ等の振興・支援策検討プロジェクトチーム 最終とりまとめの公表について(6/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
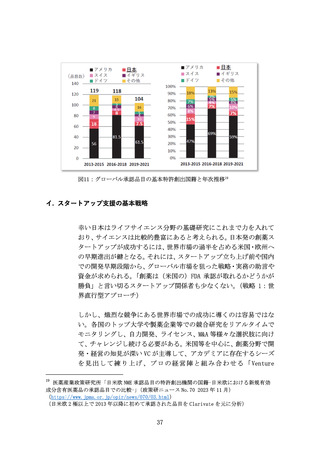
りの機会を創出しつつ、国内でのエビデンス構築が行いやすいよう
な開発環境の整備が進むことが望ましい。(戦略 2:段階的海外展開
型アプローチ)
医療機器には多種多様な製品があり、AI をはじめとする技術の進化
にも大きな影響を受ける。このため、各製品の特性や関連技術の動向
を踏まえた、医療機器スタートアップへの支援が求められる。
ウ. 具体的な振興・支援策(提言14~提言17)
医療機器スタートアップへの資金支援と臨床研究中核病院等への支
援を拡充し、命に近い革新的な治療用医療機器等の臨床エビデンス
獲得を促進する
(ア) 問題の所在
命を救うような、アンメット・メディカル・ニーズを解決する革新的
な医療機器は、通常の医療機器よりも技術開発リスクが大きく、大手
企業が許容できる範囲を超えることがある。このため、医療機器スタ
ートアップの革新的なアイデアや技術に基づく製品開発が期待され
る領域の1つであるが、特に日本では、「目利きの難しさ等から、そ
のような領域へのリスクマネー供給が特に少ない」との指摘がある。
また、そのような医療機器の開発では、FIH(First in Human、ヒト
に初めて適用する段階の治験)試験や、リアル・ワールド・データ/
リアル・ワールド・エビデンス(以下「RWD/RWE」という。)を含む
レジストリ、Cadaver試験等の臨床エビデンスを構築するための試験
環境が重要となる。しかし、侵襲性の高さ等の開発リスクから、我が
国におけるFIH試験は、臨床研究中核病院等の一部医療機関しか受入
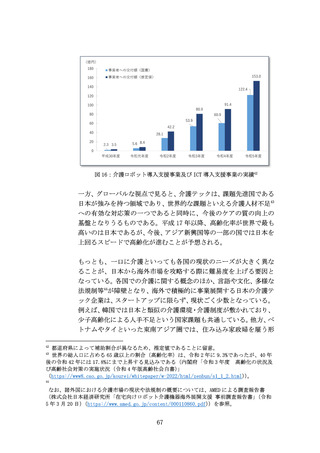
れが行われていない状況にある。RWD/RWE等のレジストリは、日本で
の整備が十分とはいえない。例えば、米国では、医療機器に関するビ
ッグデータを構築しようするNEST構想があり、MDICと呼ばれる組織
に対してFDAが約33億円の助成金を授与し、RWE/RWDを規制上の意思
47
な開発環境の整備が進むことが望ましい。(戦略 2:段階的海外展開
型アプローチ)
医療機器には多種多様な製品があり、AI をはじめとする技術の進化
にも大きな影響を受ける。このため、各製品の特性や関連技術の動向
を踏まえた、医療機器スタートアップへの支援が求められる。
ウ. 具体的な振興・支援策(提言14~提言17)
医療機器スタートアップへの資金支援と臨床研究中核病院等への支
援を拡充し、命に近い革新的な治療用医療機器等の臨床エビデンス
獲得を促進する
(ア) 問題の所在
命を救うような、アンメット・メディカル・ニーズを解決する革新的
な医療機器は、通常の医療機器よりも技術開発リスクが大きく、大手
企業が許容できる範囲を超えることがある。このため、医療機器スタ
ートアップの革新的なアイデアや技術に基づく製品開発が期待され
る領域の1つであるが、特に日本では、「目利きの難しさ等から、そ
のような領域へのリスクマネー供給が特に少ない」との指摘がある。
また、そのような医療機器の開発では、FIH(First in Human、ヒト
に初めて適用する段階の治験)試験や、リアル・ワールド・データ/
リアル・ワールド・エビデンス(以下「RWD/RWE」という。)を含む
レジストリ、Cadaver試験等の臨床エビデンスを構築するための試験
環境が重要となる。しかし、侵襲性の高さ等の開発リスクから、我が
国におけるFIH試験は、臨床研究中核病院等の一部医療機関しか受入
れが行われていない状況にある。RWD/RWE等のレジストリは、日本で
の整備が十分とはいえない。例えば、米国では、医療機器に関するビ
ッグデータを構築しようするNEST構想があり、MDICと呼ばれる組織
に対してFDAが約33億円の助成金を授与し、RWE/RWDを規制上の意思
47