よむ、つかう、まなぶ。
最終とりまとめ (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41063.html |
| 出典情報 | ヘルスケアスタートアップ等の振興・支援策検討プロジェクトチーム 最終とりまとめの公表について(6/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
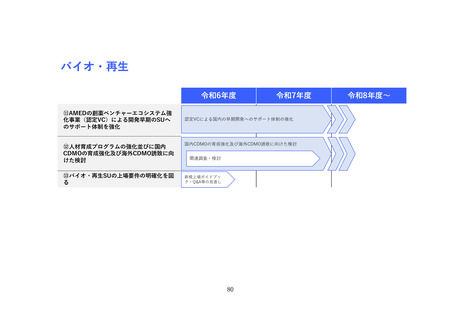
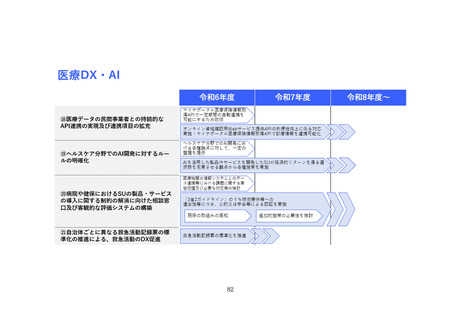
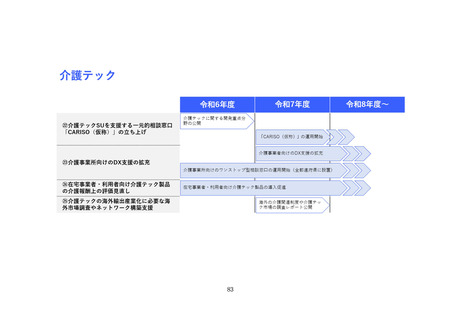
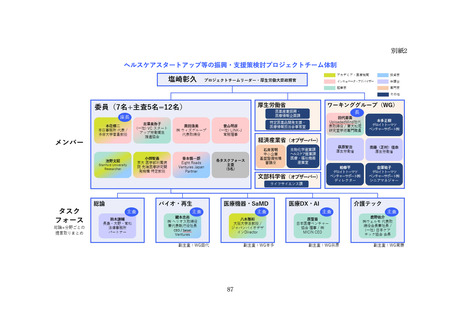
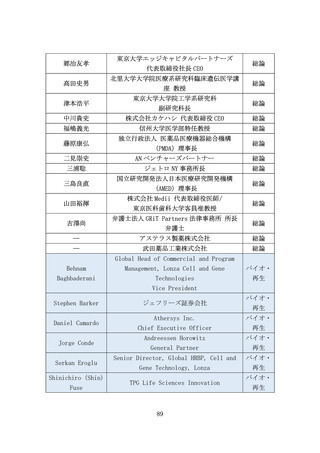
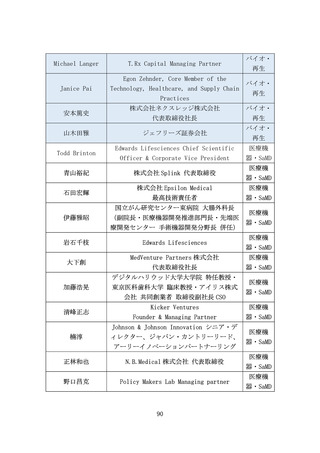
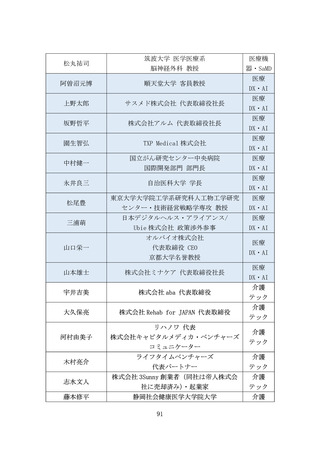
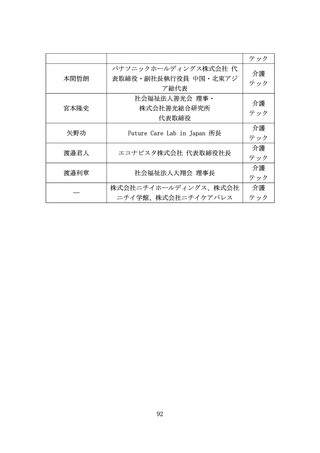
(2) バイオ・再生市場における振興・支援策について
ア. バイオ・再生市場
(ア) 市場構造の特性
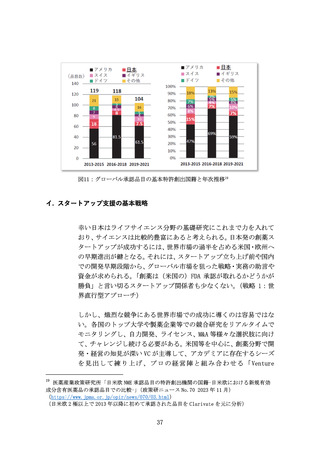
より良い医薬品へのニーズは高まっており、世界各国で激しい開発
競争が続いている。バイオ・再生製品は、米国と欧州が巨大市場を形
成し(後述)、承認審査への影響力が強い米FDA・欧EMAを中心に国際
規制ルールの整備統合(Global Harmonization)が進んできた。もは
や、多くのバイオ・再生製品開発においてFDA・EMAの承認取得は避け
て通れないと言える(なお近年、中国FDAも第三極として台頭)。
一方、再生医療等製品の規制枠組みによる条件付き承認等、一部の領
域で世界に先駆けた承認を行える環境を整えてきた日本市場にはポ
テンシャルがある。
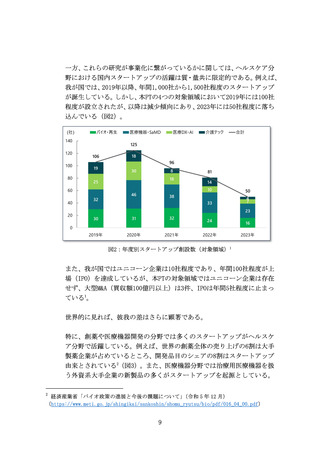
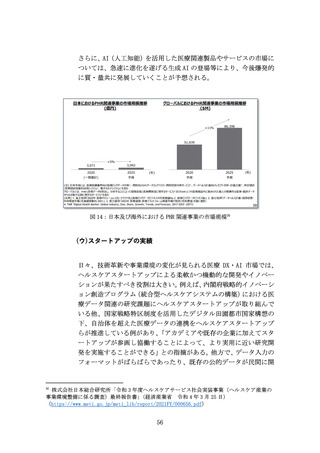
また、承認までに至る医薬品の開発・製造プロセスにおいて、CDMOの
役割がとりわけ重要となっている。近年、低分子薬や抗体医薬から、
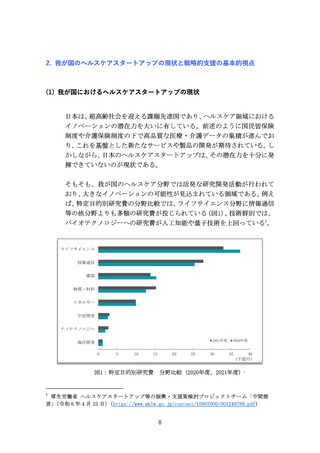
多様な新規モダリティ(例:RNAワクチン、CAR-T、遺伝子、細胞治療)
への移行が進んでおり(図7)、各モダリティに特化した専門合成技
術等の高度ノウハウに加え、培養槽等の膨大な初期投資が必要とな
る。それゆえ、一般的にバイオスタートアップや製薬企業は、世界か
ら慎重に選んだ実績あるCDMOと組むことが増えているが、日本勢は
世界で10%未満の低い市場シェアと立ち遅れている(図8)。
33
ア. バイオ・再生市場
(ア) 市場構造の特性
より良い医薬品へのニーズは高まっており、世界各国で激しい開発
競争が続いている。バイオ・再生製品は、米国と欧州が巨大市場を形
成し(後述)、承認審査への影響力が強い米FDA・欧EMAを中心に国際
規制ルールの整備統合(Global Harmonization)が進んできた。もは
や、多くのバイオ・再生製品開発においてFDA・EMAの承認取得は避け
て通れないと言える(なお近年、中国FDAも第三極として台頭)。
一方、再生医療等製品の規制枠組みによる条件付き承認等、一部の領
域で世界に先駆けた承認を行える環境を整えてきた日本市場にはポ
テンシャルがある。
また、承認までに至る医薬品の開発・製造プロセスにおいて、CDMOの
役割がとりわけ重要となっている。近年、低分子薬や抗体医薬から、
多様な新規モダリティ(例:RNAワクチン、CAR-T、遺伝子、細胞治療)
への移行が進んでおり(図7)、各モダリティに特化した専門合成技
術等の高度ノウハウに加え、培養槽等の膨大な初期投資が必要とな
る。それゆえ、一般的にバイオスタートアップや製薬企業は、世界か
ら慎重に選んだ実績あるCDMOと組むことが増えているが、日本勢は
世界で10%未満の低い市場シェアと立ち遅れている(図8)。
33