よむ、つかう、まなぶ。
最終とりまとめ (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41063.html |
| 出典情報 | ヘルスケアスタートアップ等の振興・支援策検討プロジェクトチーム 最終とりまとめの公表について(6/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
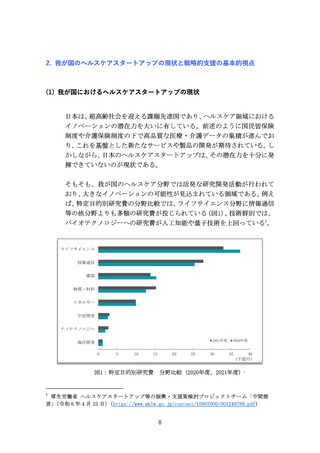
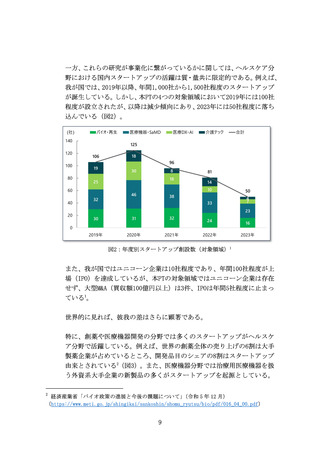
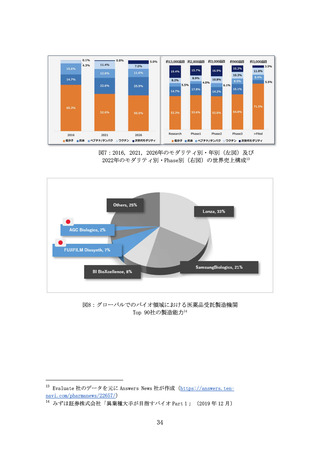
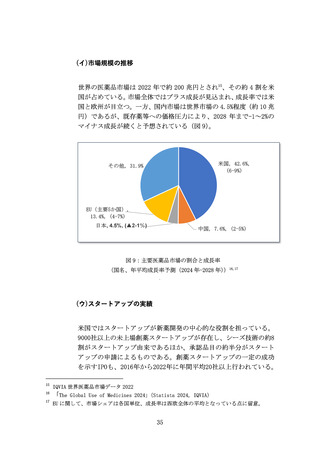
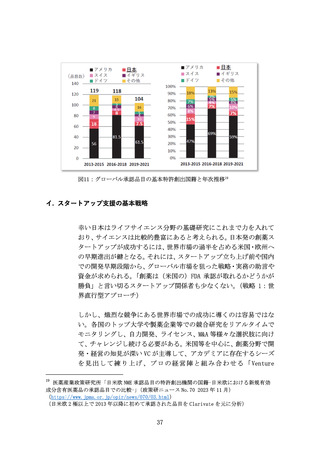
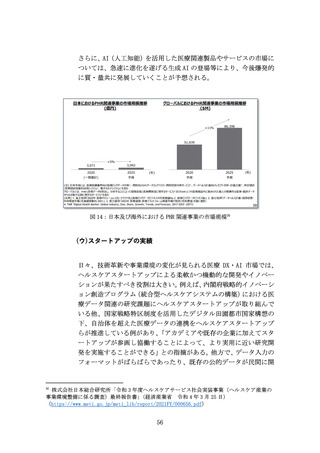
革新的な治療用医療機器等による米国をはじめとする世界市場の獲
得を目指し、医療機器スタートアップへの海外展開支援を拡充する
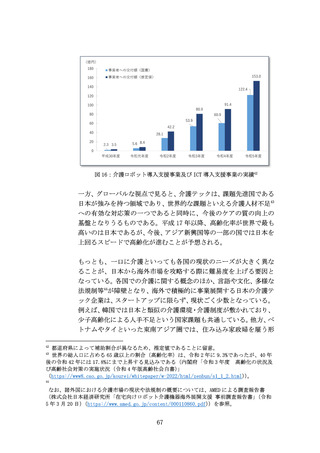
(ア) 問題の所在
国内市場の状況を踏まえると、医療機器スタートアップの成長性の
観点から、国内市場のみでは限界があるため、米国を中心とした海外
展開を図る必要がある。
患者・医師からのニーズが世界的に明確な医療機器の場合は、現地の
学会や規制当局、保険会社等のステークホルダーへの働きかけを行
い、市場投入までのプロセスを可能な限り無駄なく進めていくこと
が重要である。ニーズが明確ではない場合であっても、開発初期から
対象市場と市場投入戦略を検討することが望ましく、海外展開を見
据えたニーズ調査の実施や規制等の制度理解を深めておく必要があ
る。
いずれの場合も、高い専門性と国際的な視野、強固な現地ネットワー
クを有する人材が必要であるが、
「海外で事業開発が可能な人材や規
制対応等まで含めた支援人材は不足している」との指摘がある。
また、獲得したエビデンスの海外互換性が海外展開の際には重要と
なるが、
「日本の臨床試験環境が国際標準に合致していない部分があ
る」との指摘がある。これが理由で、現地の規制当局とのやり取りに
おいて臨床試験等の手戻りが発生し、必要以上の時間と費用を要す
る場合がある。
(イ) 提言
世界市場獲得において最も重要な米国市場獲得に向け、JETRO等の組
織と連携し、令和7年度より、海外展開戦略の構築や臨床試験等への
49
得を目指し、医療機器スタートアップへの海外展開支援を拡充する
(ア) 問題の所在
国内市場の状況を踏まえると、医療機器スタートアップの成長性の
観点から、国内市場のみでは限界があるため、米国を中心とした海外
展開を図る必要がある。
患者・医師からのニーズが世界的に明確な医療機器の場合は、現地の
学会や規制当局、保険会社等のステークホルダーへの働きかけを行
い、市場投入までのプロセスを可能な限り無駄なく進めていくこと
が重要である。ニーズが明確ではない場合であっても、開発初期から
対象市場と市場投入戦略を検討することが望ましく、海外展開を見
据えたニーズ調査の実施や規制等の制度理解を深めておく必要があ
る。
いずれの場合も、高い専門性と国際的な視野、強固な現地ネットワー
クを有する人材が必要であるが、
「海外で事業開発が可能な人材や規
制対応等まで含めた支援人材は不足している」との指摘がある。
また、獲得したエビデンスの海外互換性が海外展開の際には重要と
なるが、
「日本の臨床試験環境が国際標準に合致していない部分があ
る」との指摘がある。これが理由で、現地の規制当局とのやり取りに
おいて臨床試験等の手戻りが発生し、必要以上の時間と費用を要す
る場合がある。
(イ) 提言
世界市場獲得において最も重要な米国市場獲得に向け、JETRO等の組
織と連携し、令和7年度より、海外展開戦略の構築や臨床試験等への
49