よむ、つかう、まなぶ。
最終とりまとめ (52 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41063.html |
| 出典情報 | ヘルスケアスタートアップ等の振興・支援策検討プロジェクトチーム 最終とりまとめの公表について(6/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
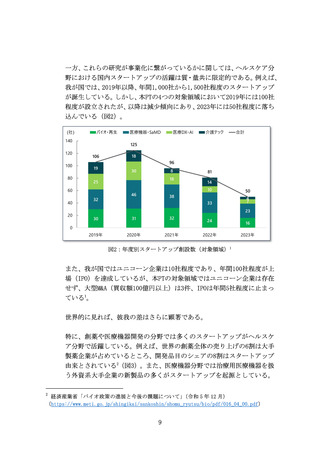
令和 6 年度には SaMD 以外の医療機器領域の調査を実施し、人的要件
の緩和が適当と判断される場合は、令和 7 年度に必要な検討を行っ
たうえで、規制緩和の適用範囲を拡大する。
SaMD の広告規制に関しては、製造販売業者や医療従事者、患者団体
等が参加するワーキンググループを令和 7 年度に立ち上げ、家庭用
の治療用アプリを対象に、承認申請時添付データ等の客観性を担保
された臨床データの広告利用を可能とすることを検討する。
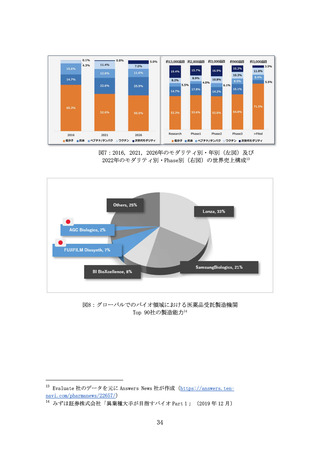
SaMDのエビデンス構築及び医療機関への普及を支援する
(ア) 問題の所在
我が国では少子高齢化に伴う医療資源不足の中で、医療従事者の負
担を軽減する手段として SaMD への期待が高まっているが、その開発
と普及が進んでいない。SaMD は医療の均てん化や業務効率化等に貢
献する場合があるものの、臨床・医療経済的アウトカムを初期に直接
立証することが困難である場合が多く、現在の制度では、そのような
場合は保険償還されても点数の上乗せによる評価はなされない。こ
うした状況の中、医療機関における採用も限られている。
例えばドイツでは、SaMD に特化した制度として「DiGA」と呼ばれる
薬事承認・保険償還の制度を設けており、SaMD を 1 つの産業として
育成する国家的意思が明確に示されている。
我が国においても「SaMD 版リバランス通知」等の SaMD が持つ特性に
合わせた制度設計が進みつつあるが、アウトカムの立証や医療現場
への普及を促進する仕組みは、まだ不十分である。
52
の緩和が適当と判断される場合は、令和 7 年度に必要な検討を行っ
たうえで、規制緩和の適用範囲を拡大する。
SaMD の広告規制に関しては、製造販売業者や医療従事者、患者団体
等が参加するワーキンググループを令和 7 年度に立ち上げ、家庭用
の治療用アプリを対象に、承認申請時添付データ等の客観性を担保
された臨床データの広告利用を可能とすることを検討する。
SaMDのエビデンス構築及び医療機関への普及を支援する
(ア) 問題の所在
我が国では少子高齢化に伴う医療資源不足の中で、医療従事者の負
担を軽減する手段として SaMD への期待が高まっているが、その開発
と普及が進んでいない。SaMD は医療の均てん化や業務効率化等に貢
献する場合があるものの、臨床・医療経済的アウトカムを初期に直接
立証することが困難である場合が多く、現在の制度では、そのような
場合は保険償還されても点数の上乗せによる評価はなされない。こ
うした状況の中、医療機関における採用も限られている。
例えばドイツでは、SaMD に特化した制度として「DiGA」と呼ばれる
薬事承認・保険償還の制度を設けており、SaMD を 1 つの産業として
育成する国家的意思が明確に示されている。
我が国においても「SaMD 版リバランス通知」等の SaMD が持つ特性に
合わせた制度設計が進みつつあるが、アウトカムの立証や医療現場
への普及を促進する仕組みは、まだ不十分である。
52