よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
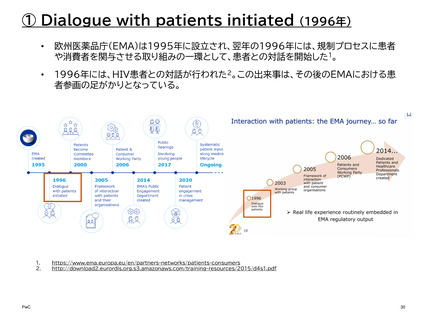
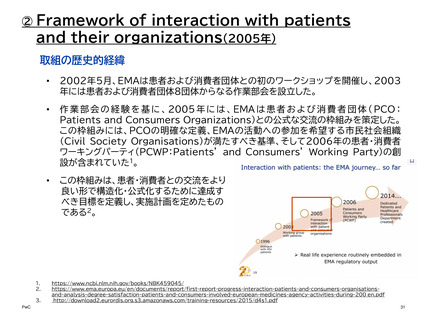
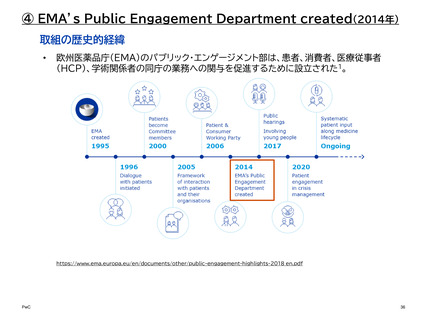
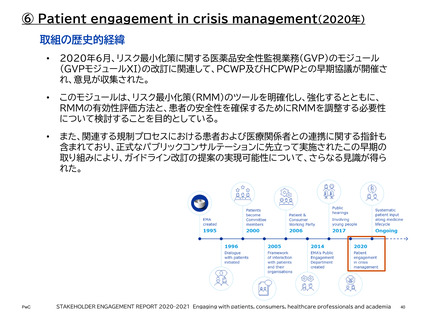
② 患者中心の医薬品開発 (PFDD: Patient-Focused Drug Development)
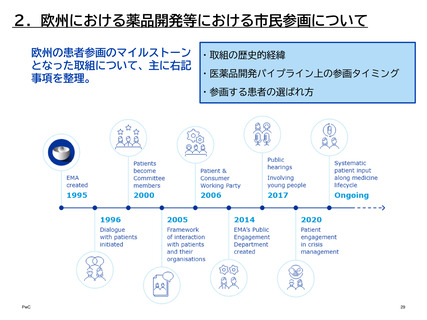
医薬品開発パイプライン上の参画タイミング
•
PFDD会議は、患者、その家族、介護者、患者支援者から、最も重要な症状、疾患が患者
の日常生活に及ぼす影響、現在利用可能な治療法の経験について直接話を聞くことがで
きる重要な機会を、FDAや医療製品開発者、医療提供者、連邦政府のパートナーを含む
その他の主要な利害関係者に提供する。
•
これらの意見は、医薬品開発中、および販売申請の審査中の両方において、FDAの決定
と監督に役立てることができる。
•
PFDDの主要な目標として以下が挙げられる。
➢ 医療製品の開発や規制上の意思決定に役立つ、患者や介護者からの信頼性が高く有
意義な意見を収集し活用するための体系的なアプローチの促進と改善を行う
➢ 患者登録を促進し、臨床試験への患者参加の負担を最小限に抑えるためのベストプ
ラクティスの特定と利用を奨励する
➢ 患者の好みに関する情報や、治療効果とリスクの結果のトレードオフの受容可能性を
把握する方法についての理解を深め、その適切な利用を促進する
➢ 市販後には、治療効果、リスク、負担に関して患者にとって最も重要な情報を特定し、
患者の意思決定を支援するために、その情報を伝える効果的な方法を決定する
https://www.fda.gov/drugs/development-approval-process-drugs/cder-patient-focused-drug-development
PwC
12
医薬品開発パイプライン上の参画タイミング
•
PFDD会議は、患者、その家族、介護者、患者支援者から、最も重要な症状、疾患が患者
の日常生活に及ぼす影響、現在利用可能な治療法の経験について直接話を聞くことがで
きる重要な機会を、FDAや医療製品開発者、医療提供者、連邦政府のパートナーを含む
その他の主要な利害関係者に提供する。
•
これらの意見は、医薬品開発中、および販売申請の審査中の両方において、FDAの決定
と監督に役立てることができる。
•
PFDDの主要な目標として以下が挙げられる。
➢ 医療製品の開発や規制上の意思決定に役立つ、患者や介護者からの信頼性が高く有
意義な意見を収集し活用するための体系的なアプローチの促進と改善を行う
➢ 患者登録を促進し、臨床試験への患者参加の負担を最小限に抑えるためのベストプ
ラクティスの特定と利用を奨励する
➢ 患者の好みに関する情報や、治療効果とリスクの結果のトレードオフの受容可能性を
把握する方法についての理解を深め、その適切な利用を促進する
➢ 市販後には、治療効果、リスク、負担に関して患者にとって最も重要な情報を特定し、
患者の意思決定を支援するために、その情報を伝える効果的な方法を決定する
https://www.fda.gov/drugs/development-approval-process-drugs/cder-patient-focused-drug-development
PwC
12