よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (46 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
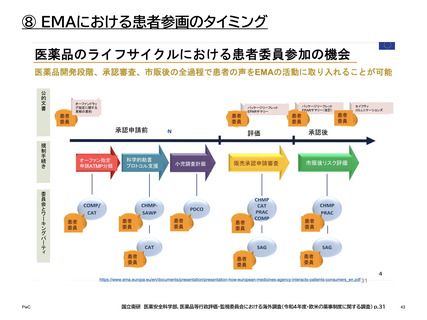
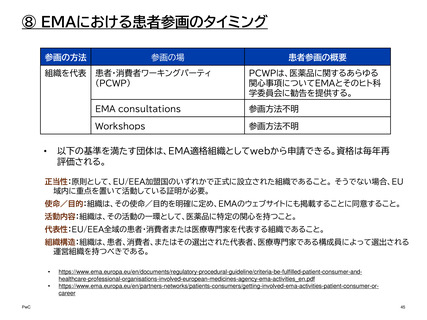
⑧ EMAにおける患者参画のタイミング
参画の方法
個人の専門家
•
•
1.
2.
PwC
参画の場
患者参画の概要
科学的助言/プロトコル支援手順
高品質で効果的かつ安全な医薬品
のタイムリーで健全な開発をサポー
トする科学的アドバイスを行う中で、
患者としての相談・助言を求められ
る。
科学諮問委員会/特別専門家グループ
参画方法不明
科学委員会の協議
参画方法不明
文書の審査
参画方法不明
個人としての参加を希望する者は、EMA
の個々の利害関係者データベースに登録
することができる1。
2022年に公表された論文によると、そ
の時点で180以上の組織と500名以上
の個人が登録されている2。
https://www.ema.europa.eu/en/documents/other/emas-individualstakeholder-database-patients-consumers-healthcare-professionalsacademia-frequently-asked-questions_en.pdf
https://www.frontiersin.org/journals/medicine/articles/10.3389/fmed.20
21.811855/full
https://fmapps.ema.europa.eu/stakeholders/signup.php
46
参画の方法
個人の専門家
•
•
1.
2.
PwC
参画の場
患者参画の概要
科学的助言/プロトコル支援手順
高品質で効果的かつ安全な医薬品
のタイムリーで健全な開発をサポー
トする科学的アドバイスを行う中で、
患者としての相談・助言を求められ
る。
科学諮問委員会/特別専門家グループ
参画方法不明
科学委員会の協議
参画方法不明
文書の審査
参画方法不明
個人としての参加を希望する者は、EMA
の個々の利害関係者データベースに登録
することができる1。
2022年に公表された論文によると、そ
の時点で180以上の組織と500名以上
の個人が登録されている2。
https://www.ema.europa.eu/en/documents/other/emas-individualstakeholder-database-patients-consumers-healthcare-professionalsacademia-frequently-asked-questions_en.pdf
https://www.frontiersin.org/journals/medicine/articles/10.3389/fmed.20
21.811855/full
https://fmapps.ema.europa.eu/stakeholders/signup.php
46