よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (65 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
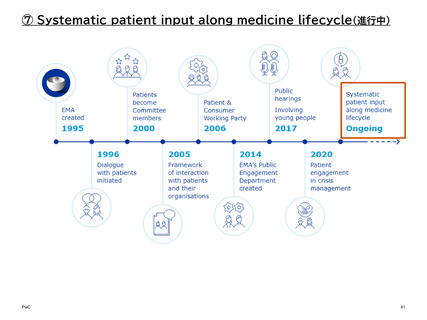
【参考】年報にみるEMAにおける患者参画の進展(2007~2023)
年次
進展の概要
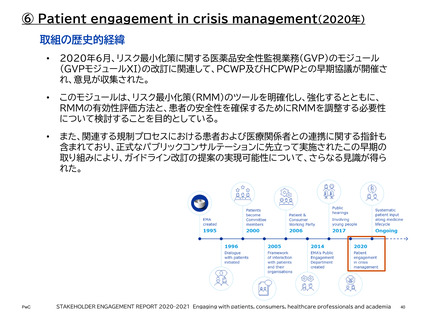
2020
~
2021
• 臨床試験規則は2022年1月末に施行され、評価および監督プロセスの調和により、EUにおける臨床試験
の実施方法を変更することになる。これは臨床試験情報システム(CTIS)を通じて促進されることになる。
PCWPおよびHCPWPは定期的に進捗状況が更新され、患者からの意見が収集された。CTISは現在稼働
中で、EMAがEU加盟国および欧州委員会と協力して維持管理することになる。このシステムは、規則で定
められているように、臨床試験のためのEUの中央ポータルおよびデータベースを提供する。臨床試験の認
可および監督は引き続き加盟国の責任であり、EMAはCTISを管理し、公開ウェブサイトへのコンテンツの
公開を監督する。一般市民は、EUで実施されているすべての臨床試験の詳細情報を、EUのすべての公用
語で閲覧できるようになる。
(続き)
• 2021年9月に設立された庁全体のインフラである「学術機関連携マトリクス」は、学術機関との関連活動の
一貫性、体系性、効率性を高めることを目的としている。学術機関連携マトリクスは、EMAの2022年から
2024年の計画文書、2025年までのレギュラトリーサイエンス戦略に沿った行動計画を策定し、学術機関
との最適な連携を実現するためにEMAが追求すべき目標を明確にした。この概要に示された行動の実施
には、この連携が調整され、知識共有を基盤とし、規制科学およびパートナーシップ、イノベーション、コミュ
ニケーション、研修、イベントという5つの戦略的領域において、学術界とのパートナーシップを発展させる
ために、EMAの各部門に権限を与えることを確実にするための、機関横断的なアプローチが必要である。
• 医薬品の規制は、高い規制基準と専門性を維持しながら、進化する科学と医療開発のペースの変化に追い
ついていかなければならない。規制当局はまた、基礎研究とイノベーションを患者中心の医薬品アクセスへ
と転換させることも求められる。これを達成するために、EMAは科学委員会、利害関係者、EUの規制パー
トナーとの広範なアウトリーチ、分析、協議に長い期間を費やしました。こうした意見を参考に、EMAは5ヵ
年戦略を策定し、2020年3月に発表した。パブリックコンサルテーションの分析とレギュラトリーサイエン
スにおける現在の知識のギャップを活用し、中核となる一連の推奨事項が優先され、「EMAレギュラトリー
サイエンス研究ニーズ(RSRN)」にまとめられた。これは、研究者や資金提供機関がこれらのニーズに取り
組むことを支援するイニシアティブであり、PCWPとHCPWPも貢献している。
出典:STAKEHOLDER ENGAGEMENT REPORT 2020–2021 Engaging with patients, consumers,
healthcare professionals and academia
PwC
65
年次
進展の概要
2020
~
2021
• 臨床試験規則は2022年1月末に施行され、評価および監督プロセスの調和により、EUにおける臨床試験
の実施方法を変更することになる。これは臨床試験情報システム(CTIS)を通じて促進されることになる。
PCWPおよびHCPWPは定期的に進捗状況が更新され、患者からの意見が収集された。CTISは現在稼働
中で、EMAがEU加盟国および欧州委員会と協力して維持管理することになる。このシステムは、規則で定
められているように、臨床試験のためのEUの中央ポータルおよびデータベースを提供する。臨床試験の認
可および監督は引き続き加盟国の責任であり、EMAはCTISを管理し、公開ウェブサイトへのコンテンツの
公開を監督する。一般市民は、EUで実施されているすべての臨床試験の詳細情報を、EUのすべての公用
語で閲覧できるようになる。
(続き)
• 2021年9月に設立された庁全体のインフラである「学術機関連携マトリクス」は、学術機関との関連活動の
一貫性、体系性、効率性を高めることを目的としている。学術機関連携マトリクスは、EMAの2022年から
2024年の計画文書、2025年までのレギュラトリーサイエンス戦略に沿った行動計画を策定し、学術機関
との最適な連携を実現するためにEMAが追求すべき目標を明確にした。この概要に示された行動の実施
には、この連携が調整され、知識共有を基盤とし、規制科学およびパートナーシップ、イノベーション、コミュ
ニケーション、研修、イベントという5つの戦略的領域において、学術界とのパートナーシップを発展させる
ために、EMAの各部門に権限を与えることを確実にするための、機関横断的なアプローチが必要である。
• 医薬品の規制は、高い規制基準と専門性を維持しながら、進化する科学と医療開発のペースの変化に追い
ついていかなければならない。規制当局はまた、基礎研究とイノベーションを患者中心の医薬品アクセスへ
と転換させることも求められる。これを達成するために、EMAは科学委員会、利害関係者、EUの規制パー
トナーとの広範なアウトリーチ、分析、協議に長い期間を費やしました。こうした意見を参考に、EMAは5ヵ
年戦略を策定し、2020年3月に発表した。パブリックコンサルテーションの分析とレギュラトリーサイエン
スにおける現在の知識のギャップを活用し、中核となる一連の推奨事項が優先され、「EMAレギュラトリー
サイエンス研究ニーズ(RSRN)」にまとめられた。これは、研究者や資金提供機関がこれらのニーズに取り
組むことを支援するイニシアティブであり、PCWPとHCPWPも貢献している。
出典:STAKEHOLDER ENGAGEMENT REPORT 2020–2021 Engaging with patients, consumers,
healthcare professionals and academia
PwC
65