よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (63 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
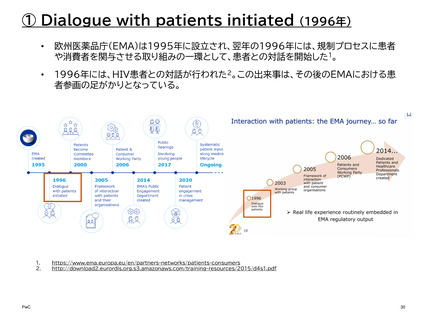
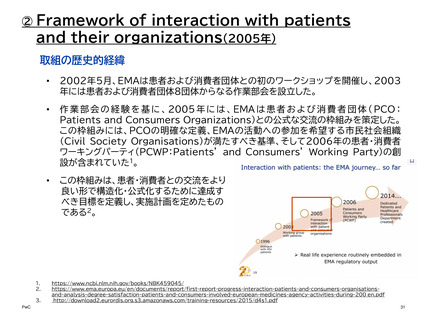
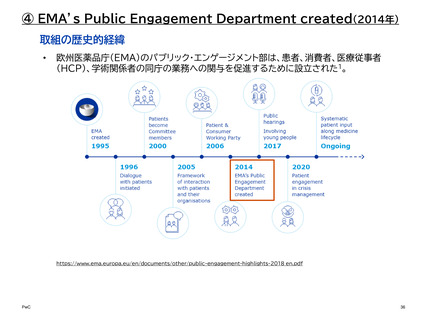
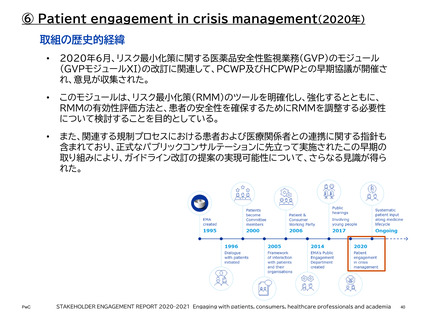
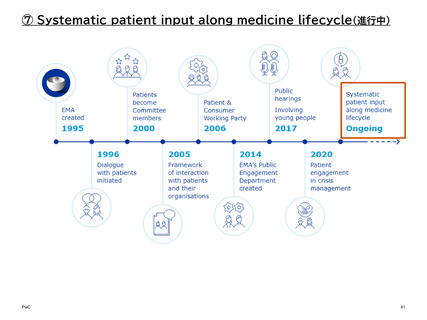
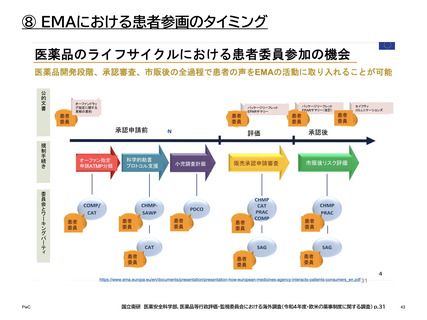
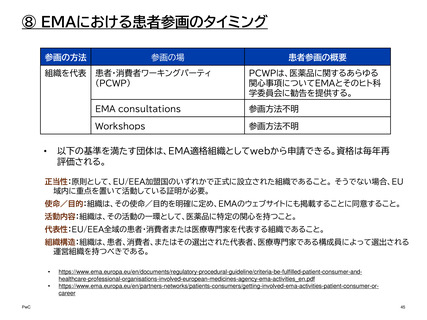
【参考】年報にみるEMAにおける患者参画の進展(2007~2023)
年次
進展の概要
2020
~
2021
• 2018年現在、EUにおける個人データの保護に関する新たな枠組みとして一般データ保護規則(GDPR)
が制定された。2020年9月のPCWP/HCPWP合同会議では、医療分野におけるGDPRの適用とデータ
の二次利用に関する概要が発表されました。この会議では、欧州委員会のEU Health Data Space
(EU健康データ空間)、EU全域にわたるガバナンスの枠組みと行動規範の開発、EMA-HMA共同ビッグ
データ運営委員会(BDSG)の取り組みについても貴重な洞察が提供された。患者団体や医療従事者団体
を含むステークホルダーからの意見は、これらのEUイニシアチブの進展にとって極めて重要ある。また、ス
テークホルダーがGDPRを理解し、活用できるよう、EMAが作成中のQ&A文書にも、これらの意見や懸
念が反映される予定である。
(続き)
• 学術分野は革新的な医薬品開発において重要な役割を果たしており、このグループをより良く支援するた
めの体制を整える必要性が以前から指摘されてきた。そのため、欧州医薬品庁と学術界との協力の枠組み
に基づき、2020年3月にアカデミア・リエゾン(学術界との連携担当)の役職が新設された。アカデミア・リ
エゾンは、学術界のネットワークとの連携を調整し、関連トピックに関する学術界向けのイベント、研修、教
育機会の共同設計を行う。また、規制科学戦略の開発、EU資金によるプロジェクトへの関与、欧州の主要
機関とのコミュニケーションもサポートしている。さらに、アカデミア・リエゾンは、アカデミアとEMAおよび
そのネットワークとの交流の窓口としても機能している。
• EUの規制当局との早期のやりとりは、学術機関が規制要件を理解し、医薬品の有益性とリスクを立証する
ために必要な確固たるエビデンスの作成を可能にするために重要である。これにより、規制プロセスを円滑
に進め、最終的に発見を患者中心の承認医薬品へと転換することができる。
• アカデミアから寄せられたフィードバックによると、プロトコール支援(希少疾病用医薬品に対する科学的
助言)にかかる規制手数料がEMAとの関わりにおける障壁となっていることが示されたため、同庁は
2020年6月、希少疾病用医薬品を開発するアカデミアに対する科学的助言にかかる手数料をすべて免除
することを決定した。
出典:STAKEHOLDER ENGAGEMENT REPORT 2020–2021 Engaging with patients, consumers,
healthcare professionals and academia
PwC
63
年次
進展の概要
2020
~
2021
• 2018年現在、EUにおける個人データの保護に関する新たな枠組みとして一般データ保護規則(GDPR)
が制定された。2020年9月のPCWP/HCPWP合同会議では、医療分野におけるGDPRの適用とデータ
の二次利用に関する概要が発表されました。この会議では、欧州委員会のEU Health Data Space
(EU健康データ空間)、EU全域にわたるガバナンスの枠組みと行動規範の開発、EMA-HMA共同ビッグ
データ運営委員会(BDSG)の取り組みについても貴重な洞察が提供された。患者団体や医療従事者団体
を含むステークホルダーからの意見は、これらのEUイニシアチブの進展にとって極めて重要ある。また、ス
テークホルダーがGDPRを理解し、活用できるよう、EMAが作成中のQ&A文書にも、これらの意見や懸
念が反映される予定である。
(続き)
• 学術分野は革新的な医薬品開発において重要な役割を果たしており、このグループをより良く支援するた
めの体制を整える必要性が以前から指摘されてきた。そのため、欧州医薬品庁と学術界との協力の枠組み
に基づき、2020年3月にアカデミア・リエゾン(学術界との連携担当)の役職が新設された。アカデミア・リ
エゾンは、学術界のネットワークとの連携を調整し、関連トピックに関する学術界向けのイベント、研修、教
育機会の共同設計を行う。また、規制科学戦略の開発、EU資金によるプロジェクトへの関与、欧州の主要
機関とのコミュニケーションもサポートしている。さらに、アカデミア・リエゾンは、アカデミアとEMAおよび
そのネットワークとの交流の窓口としても機能している。
• EUの規制当局との早期のやりとりは、学術機関が規制要件を理解し、医薬品の有益性とリスクを立証する
ために必要な確固たるエビデンスの作成を可能にするために重要である。これにより、規制プロセスを円滑
に進め、最終的に発見を患者中心の承認医薬品へと転換することができる。
• アカデミアから寄せられたフィードバックによると、プロトコール支援(希少疾病用医薬品に対する科学的
助言)にかかる規制手数料がEMAとの関わりにおける障壁となっていることが示されたため、同庁は
2020年6月、希少疾病用医薬品を開発するアカデミアに対する科学的助言にかかる手数料をすべて免除
することを決定した。
出典:STAKEHOLDER ENGAGEMENT REPORT 2020–2021 Engaging with patients, consumers,
healthcare professionals and academia
PwC
63