よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (61 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
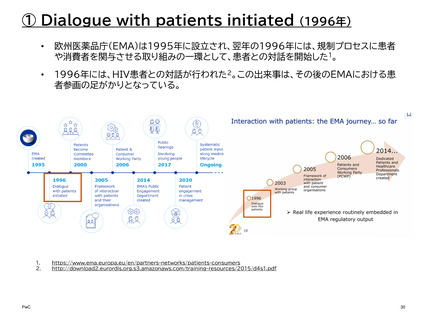
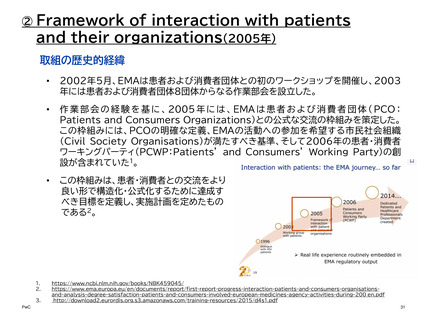
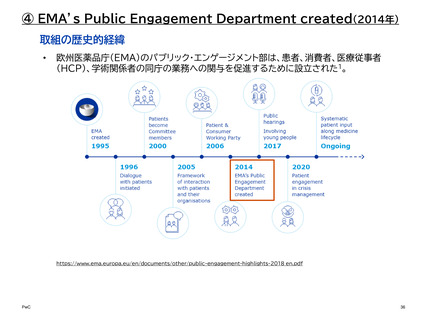
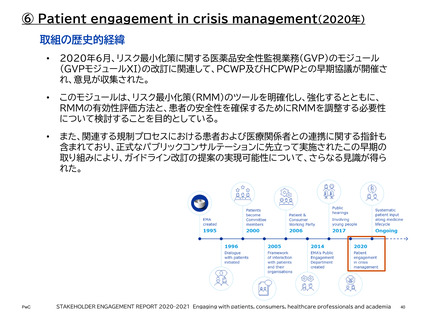
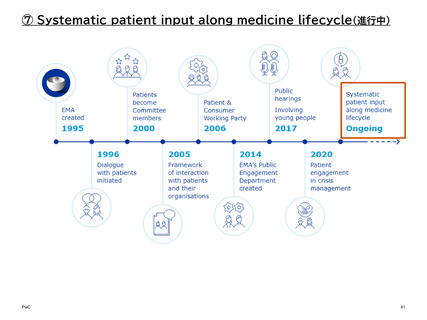
【参考】年報等にみるEMAにおける患者参画の進展(2007~2023)
年次
2018
~
2019
(続き)
進展の概要
➢ 臨床試験規則に関する最新情報が2018年と2019年の両方で提供された。この規則の目的は、被験者の安
全性に関する最高水準と試験情報の透明性向上を確保し、EUにおける臨床試験の実施に適した環境を創出す
ることである。臨床試験情報システム(CTIS)には、臨床試験のためのEUのポータルサイトとデータベースが一
元化される。EMAは、欧州委員会、EU加盟国、倫理委員会と協力してCTISの開発に取り組んでいる。規制を
実施するために必要なシステムの構築には、患者や医療従事者を含む利害関係者からの意見が不可欠である。
➢ 「2025年までのレギュラトリーサイエンス」と題された戦略を通じて、ステークホルダーはEMAのレギュラト
リーサイエンスの推進に貢献した。2019年に実施されたパブリックコンサルテーションでは約150の個人およ
び組織から回答が寄せられ、2つのステークホルダーワークショップではさらなる協議と意見提出が可能となっ
た。最終的な提言が公表された。
➢ 2019年にEMAの評価の一環として、メトトレキサートの使用に伴う重大なエラーのリスクを最小限に抑える
ことを目的としたマルチステークホルダー会議が開催された。この会議では、患者との話し合いを促進するた
めに、処方者/薬剤師向けの患者カードやチェックリストの導入などの提言がなされた。
➢ サルタン系血圧降下剤(アンジオテンシンII受容体拮抗剤としても知られる)にニトロソアミン不純物が検出され
たことを受け、教訓を学ぶための取り組みの一環として、2019年に医療従事者団体、患者団体、業界団体、国
際規制当局の代表者による多者間会議が開催された。患者の懸念に対処できるよう、医療従事者から患者に
情報をより早く共有してほしいという要望など、ステークホルダーから重要な意見が寄せられ、公開報告書の
作成に役立てられた。同様に、患者は規制当局に早期の助言と平易な言葉によるリスクの明確な説明を求めた。
➢ 患者および医療従事者を代表するEMA委員会メンバーの役割を説明する文書が更新され、これらのメンバー
がEMAのさまざまな科学委員会に参加するための支援活動に関する情報や、欧州委員会の指名プロセスに関
する情報が追加された。
➢ 認可された医薬品が「研究室から患者に届くまで」の道のりを説明した参考小冊子が作成され、EUの複数の言
語で入手可能となった。この小冊子では、EMAを通じて認可された医薬品が、規制当局による評価を経て承
認・販売に至るまでの開発・進展の過程が説明されている。
➢ CHMPによるベネフィット・リスク評価における患者の関与に関する現在の手法は、現在行われている口頭で
の説明や科学会議への専門家の参加に加え、書面による協議に重点を置いて拡充された。
• BCPの限界にもかかわらず、PCWPおよびHCPWPは、バーチャルおよび対面式の会議を開催し、新しい
作業部会の任務の準備を含む重要なトピックに関する継続的な意見交換を可能にした。PCWPと
HCPWPの3年間の共同作業計画(2019年~2022年)が策定された。2019年6月より、両作業部会で
新しい委任が開始され、9月の会議で共同議長が選出された。
PwC
出典:STAKEHOLDER ENGAGEMENT REPORT 2018–2019 Engaging with patients, consumers,
healthcare professionals and academia
61
年次
2018
~
2019
(続き)
進展の概要
➢ 臨床試験規則に関する最新情報が2018年と2019年の両方で提供された。この規則の目的は、被験者の安
全性に関する最高水準と試験情報の透明性向上を確保し、EUにおける臨床試験の実施に適した環境を創出す
ることである。臨床試験情報システム(CTIS)には、臨床試験のためのEUのポータルサイトとデータベースが一
元化される。EMAは、欧州委員会、EU加盟国、倫理委員会と協力してCTISの開発に取り組んでいる。規制を
実施するために必要なシステムの構築には、患者や医療従事者を含む利害関係者からの意見が不可欠である。
➢ 「2025年までのレギュラトリーサイエンス」と題された戦略を通じて、ステークホルダーはEMAのレギュラト
リーサイエンスの推進に貢献した。2019年に実施されたパブリックコンサルテーションでは約150の個人およ
び組織から回答が寄せられ、2つのステークホルダーワークショップではさらなる協議と意見提出が可能となっ
た。最終的な提言が公表された。
➢ 2019年にEMAの評価の一環として、メトトレキサートの使用に伴う重大なエラーのリスクを最小限に抑える
ことを目的としたマルチステークホルダー会議が開催された。この会議では、患者との話し合いを促進するた
めに、処方者/薬剤師向けの患者カードやチェックリストの導入などの提言がなされた。
➢ サルタン系血圧降下剤(アンジオテンシンII受容体拮抗剤としても知られる)にニトロソアミン不純物が検出され
たことを受け、教訓を学ぶための取り組みの一環として、2019年に医療従事者団体、患者団体、業界団体、国
際規制当局の代表者による多者間会議が開催された。患者の懸念に対処できるよう、医療従事者から患者に
情報をより早く共有してほしいという要望など、ステークホルダーから重要な意見が寄せられ、公開報告書の
作成に役立てられた。同様に、患者は規制当局に早期の助言と平易な言葉によるリスクの明確な説明を求めた。
➢ 患者および医療従事者を代表するEMA委員会メンバーの役割を説明する文書が更新され、これらのメンバー
がEMAのさまざまな科学委員会に参加するための支援活動に関する情報や、欧州委員会の指名プロセスに関
する情報が追加された。
➢ 認可された医薬品が「研究室から患者に届くまで」の道のりを説明した参考小冊子が作成され、EUの複数の言
語で入手可能となった。この小冊子では、EMAを通じて認可された医薬品が、規制当局による評価を経て承
認・販売に至るまでの開発・進展の過程が説明されている。
➢ CHMPによるベネフィット・リスク評価における患者の関与に関する現在の手法は、現在行われている口頭で
の説明や科学会議への専門家の参加に加え、書面による協議に重点を置いて拡充された。
• BCPの限界にもかかわらず、PCWPおよびHCPWPは、バーチャルおよび対面式の会議を開催し、新しい
作業部会の任務の準備を含む重要なトピックに関する継続的な意見交換を可能にした。PCWPと
HCPWPの3年間の共同作業計画(2019年~2022年)が策定された。2019年6月より、両作業部会で
新しい委任が開始され、9月の会議で共同議長が選出された。
PwC
出典:STAKEHOLDER ENGAGEMENT REPORT 2018–2019 Engaging with patients, consumers,
healthcare professionals and academia
61