よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (60 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
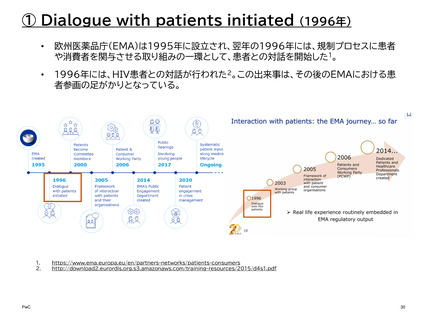
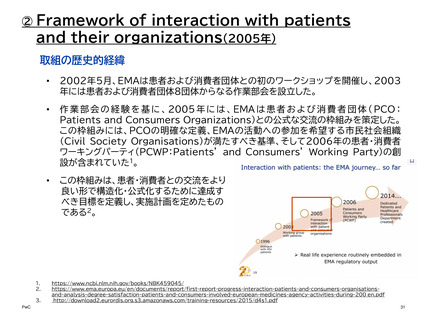
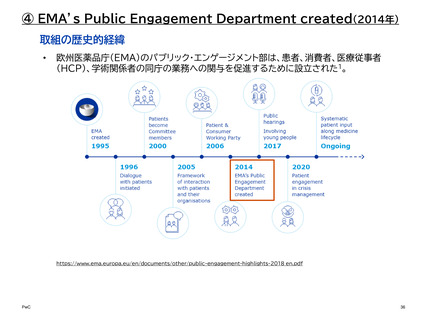
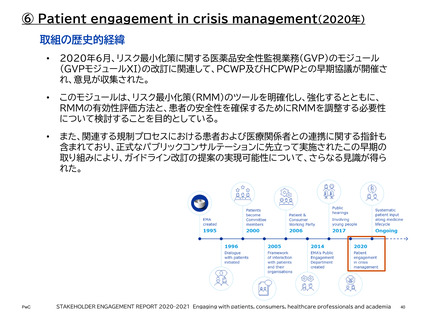
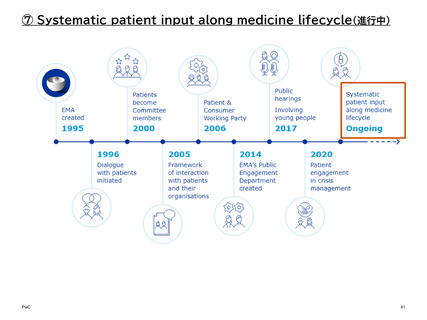
【参考】年報等にみるEMAにおける患者参画の進展(2007~2023)
年次
進展の概要
2018
~
2019
• ここ数年、EMAは数々の課題に直面してきた。特に、英国のEU離脱とそれに伴うEMAのアムステルダム
への移転(2020年1月中旬に完了)である。移転を管理するために、EMAは公衆衛生に不可欠な中核的
業務に重点を置いたBCPを実施した。
• BCPの一環として、年次利害関係者関与報告は実施されず、2018年と2019年の2年ごとの報告書がこ
こに提示されている。この期間中、特定の医薬品の評価における利害関係者の関与は引き続きEMAの優
先事項であったが、一般的なトピックに関する利害関係者の関与は優先度が下げられた。
• 2019年6月、EMAはUEMOおよびWONCA(一般開業医を代表する2つの主要組織)およびEFPC(欧
州のプライマリケア専門家の主要組織)と共同声明に署名し、一般開業医(GPs)との連携を強化した。これ
により、EMAは特定の規制措置が患者ケアに与える影響についてより深く理解できるようになり、プライ
マリケアの現場で医薬品がどのように使用されているかについて処方者から直接見解を収集できるように
なる。また、プライマリケアの専門家に対して、EUの医薬品規制ネットワークの役割と活動について認識を
高めることにもなる。
• 報告期間中のその他の主な取組は以下の通りである。
➢ 2018年に実施されたキノロン系およびフルオロキノロン系含有医薬品に関する2回目の公聴会では、これら
の医薬品による影響を受けた人々の証言がEMAの安全性委員会(PRAC)に貴重な意見をもたらし、同委員会
の最終勧告に大きく貢献した。
➢ 2018年には、EMA、欧州医薬品庁長官会議(HMA)、欧州委員会(EC)が共同で主催した電子製品情報
(ePI)に関するマルチステークホルダーワークショップが開催された。これは、EUにおけるePIの開発と利用
を導く共通の主要原則について、すべてのステークホルダーと1年間にわたってマッピング、分析、協議を行っ
た結果である。次のステップは、これらの原則の実施に関わるもので、ePIの共通基準を定義し、パイロット
フェーズ用のツールを提供するプロジェクトが含まれる。このようなパイロットでは、EMAおよび一部の国内規
制当局がePIをテストし、その影響を評価する。
➢ 承認済み医薬品の不足と供給は、患者、消費者、医療従事者にとって依然として重大な問題である。これらの利
害関係者は製薬業界とともに、承認済み医薬品の供給に関するHMAEMAタスクフォースの作業に貢献した。
タスクフォースは、医薬品の供給問題のより良い予防、特定、管理、コミュニケーションを目的として設立された。
2018年11月のワークショップでは、タスクフォースの進行中の活動、期待される成果、およびこれらの成果に
対するステークホルダーの貢献の重要性の強化に関する情報が提供された。
PwC
出典:STAKEHOLDER ENGAGEMENT REPORT 2018–2019 Engaging with patients, consumers,
healthcare professionals and academia
60
年次
進展の概要
2018
~
2019
• ここ数年、EMAは数々の課題に直面してきた。特に、英国のEU離脱とそれに伴うEMAのアムステルダム
への移転(2020年1月中旬に完了)である。移転を管理するために、EMAは公衆衛生に不可欠な中核的
業務に重点を置いたBCPを実施した。
• BCPの一環として、年次利害関係者関与報告は実施されず、2018年と2019年の2年ごとの報告書がこ
こに提示されている。この期間中、特定の医薬品の評価における利害関係者の関与は引き続きEMAの優
先事項であったが、一般的なトピックに関する利害関係者の関与は優先度が下げられた。
• 2019年6月、EMAはUEMOおよびWONCA(一般開業医を代表する2つの主要組織)およびEFPC(欧
州のプライマリケア専門家の主要組織)と共同声明に署名し、一般開業医(GPs)との連携を強化した。これ
により、EMAは特定の規制措置が患者ケアに与える影響についてより深く理解できるようになり、プライ
マリケアの現場で医薬品がどのように使用されているかについて処方者から直接見解を収集できるように
なる。また、プライマリケアの専門家に対して、EUの医薬品規制ネットワークの役割と活動について認識を
高めることにもなる。
• 報告期間中のその他の主な取組は以下の通りである。
➢ 2018年に実施されたキノロン系およびフルオロキノロン系含有医薬品に関する2回目の公聴会では、これら
の医薬品による影響を受けた人々の証言がEMAの安全性委員会(PRAC)に貴重な意見をもたらし、同委員会
の最終勧告に大きく貢献した。
➢ 2018年には、EMA、欧州医薬品庁長官会議(HMA)、欧州委員会(EC)が共同で主催した電子製品情報
(ePI)に関するマルチステークホルダーワークショップが開催された。これは、EUにおけるePIの開発と利用
を導く共通の主要原則について、すべてのステークホルダーと1年間にわたってマッピング、分析、協議を行っ
た結果である。次のステップは、これらの原則の実施に関わるもので、ePIの共通基準を定義し、パイロット
フェーズ用のツールを提供するプロジェクトが含まれる。このようなパイロットでは、EMAおよび一部の国内規
制当局がePIをテストし、その影響を評価する。
➢ 承認済み医薬品の不足と供給は、患者、消費者、医療従事者にとって依然として重大な問題である。これらの利
害関係者は製薬業界とともに、承認済み医薬品の供給に関するHMAEMAタスクフォースの作業に貢献した。
タスクフォースは、医薬品の供給問題のより良い予防、特定、管理、コミュニケーションを目的として設立された。
2018年11月のワークショップでは、タスクフォースの進行中の活動、期待される成果、およびこれらの成果に
対するステークホルダーの貢献の重要性の強化に関する情報が提供された。
PwC
出典:STAKEHOLDER ENGAGEMENT REPORT 2018–2019 Engaging with patients, consumers,
healthcare professionals and academia
60