よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
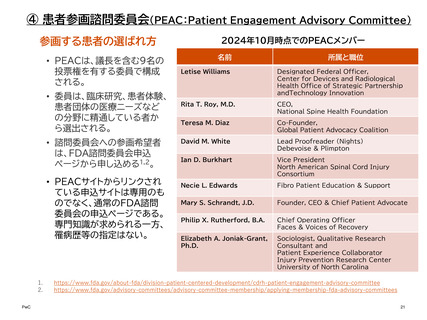
④ 患者参画諮問委員会(PEAC:Patient Engagement Advisory Committee)
患者参画諮問委員会(PEAC)は、医療機器の規制や使用に関する複雑な問題について、
患者や介護者がそれぞれのニーズと体験をFDAと共有、また議論することで今後の技
術革新、開発、評価、導入に情報を提供している。
取組の歴史的経緯
•
FDAは、医療機器の規制と患者によるその使用に関する複雑な問題に関するFDAの審
議に、患者のニーズと経験が確実に考慮されるようにするための諮問委員会を2017年
に設立した。
最新動向
2024年10月30日に、FDA規制医療製品の臨床試験における患者中心のインフォームドコンセントについ
て議論し、推奨事項を作成するための患者参画諮問委員会がオンラインで開催された。
内容:インフォームドコンセントは臨床試験の重要な要素であるが、フォームが長く、研究参加者が理解しに
くい点に課題がある。今回の諮問委員会では、インフォームドコンセントのプロセスとインフォームドコ
ンセントの焦点領域に関する推奨事項および、臨床試験の参加者に伝える際に考慮すべき要素に関
する推奨事項を作成する。
• 議論の背景資料が、2営業日前までにwebサイトに公開。
• 会議はYouTubeでライブ配信。
• 議題に関するデータ、意見、情報は口頭または書面で提出できる。書面での提供は10月3日まで、口頭発表を希
望する場合は、9月25日までにFDAの担当者に詳細を提出する。
• シナリオ議論セッションに参加したい場合は10月16日までに参加登録が必要。定員150名。
1.
2.
PwC
https://www.fda.gov/about-fda/division-patient-centered-development/cdrh-patient-engagement-advisory-committee
https://www.fda.gov/advisory-committees/advisory-committee-calendar/october-30-2024-patient-engagement-advisorycommittee-meeting-announcement-10302024#event-information
17
患者参画諮問委員会(PEAC)は、医療機器の規制や使用に関する複雑な問題について、
患者や介護者がそれぞれのニーズと体験をFDAと共有、また議論することで今後の技
術革新、開発、評価、導入に情報を提供している。
取組の歴史的経緯
•
FDAは、医療機器の規制と患者によるその使用に関する複雑な問題に関するFDAの審
議に、患者のニーズと経験が確実に考慮されるようにするための諮問委員会を2017年
に設立した。
最新動向
2024年10月30日に、FDA規制医療製品の臨床試験における患者中心のインフォームドコンセントについ
て議論し、推奨事項を作成するための患者参画諮問委員会がオンラインで開催された。
内容:インフォームドコンセントは臨床試験の重要な要素であるが、フォームが長く、研究参加者が理解しに
くい点に課題がある。今回の諮問委員会では、インフォームドコンセントのプロセスとインフォームドコ
ンセントの焦点領域に関する推奨事項および、臨床試験の参加者に伝える際に考慮すべき要素に関
する推奨事項を作成する。
• 議論の背景資料が、2営業日前までにwebサイトに公開。
• 会議はYouTubeでライブ配信。
• 議題に関するデータ、意見、情報は口頭または書面で提出できる。書面での提供は10月3日まで、口頭発表を希
望する場合は、9月25日までにFDAの担当者に詳細を提出する。
• シナリオ議論セッションに参加したい場合は10月16日までに参加登録が必要。定員150名。
1.
2.
PwC
https://www.fda.gov/about-fda/division-patient-centered-development/cdrh-patient-engagement-advisory-committee
https://www.fda.gov/advisory-committees/advisory-committee-calendar/october-30-2024-patient-engagement-advisorycommittee-meeting-announcement-10302024#event-information
17