よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (58 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
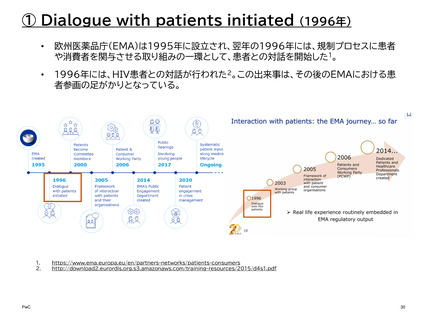
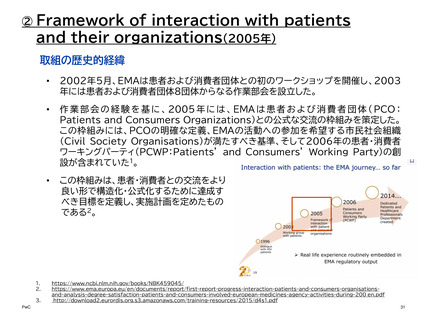
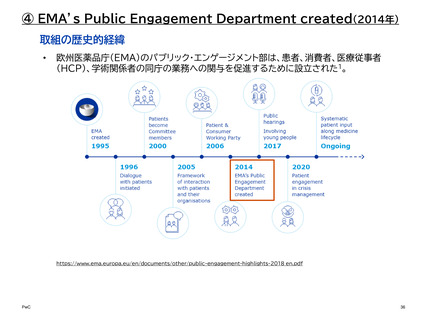
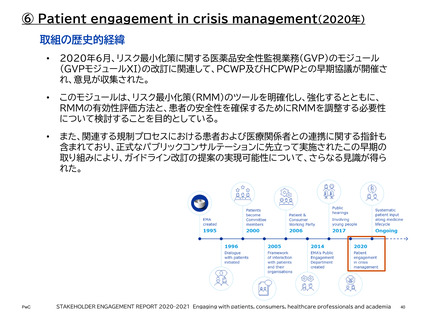
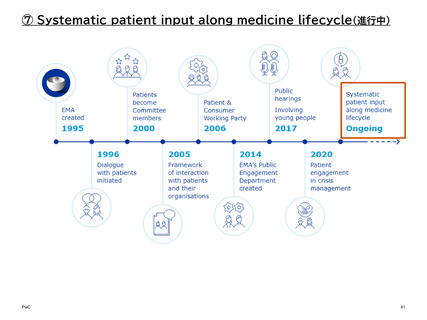
【参考】年報等にみるEMAにおける患者参画の進展(2007~2023)
年次
進展の概要
2017
• EMAは移転と英国のEU離脱に備え、2017年に事業継続計画(BCP)の第一段階を開始した。その結果、
一部の業務の優先順位が変更され、中断または延期され、ブレグジットへの準備活動と中核的業務の保護
にリソースが割り当てられることになった。特に優先されたのは、9月26日に開催された初の公聴会の準
備であった。このイベントには、バルプロ酸含有医薬品のリスクを最小限に抑える追加措置について話し合
うために、患者、介護者、医療従事者、その他の利害関係者が集まった。一般市民からの意見は、バルプロ
酸の評価を最終決定し、リスクのある女性を保護するための新たな措置を推奨する上で重要な役割を果た
した。その他の市民参加のハイライトには、以下のものがあった。
➢ レチノイドおよびバルプロ酸の評価期間中には、関係者との専用会議を通じて重要な意見も得られた。患者お
よび医療従事者は、PRACによる勧告作成を支援するために専門家の意見や経験を提供した。
➢ CHMPの口頭説明におけるベネフィット・リスクに関する議論に患者を関与させることに合意した。パイロット
版は終了し、報告書が公表された。EMAの管理委員会は、EMAの活動に若者を関与させる原則に合意した。
➢ EMAは、この分野において正式に前進した最初の医薬品規制当局のひとつであり、この重要な患者グループ
からの意見収集を促進する枠組みを提供している。
➢ 2016年のワークショップを基に、一般開業医を代表するさまざまなグループとのさらなる対話を行った。これ
は規制活動への関与を強化・改善することを目的とするものである。
➢ 患者および医療従事者を代表するEMAの委員会メンバーに対する、より合理化された効率的な支援が現在検
討されており、委員会内での役割遂行を支援することを目的とする。
➢ 既存の枠組みのポートフォリオを補完するものとして、EMAの管理委員会は学術機関との協力のための枠組
みを採択した。必要に応じて更新・改良される行動計画に従って、実施段階が開始された。
➢ 合計131人の患者が科学的助言手続きに参加し、その中には医療技術評価(HTA)機関との18件の共同助言
手続きも含まれている。
出典:Stakeholder Engagement report 2017 Patients, consumers, healthcare professionals, academics
and their organisations
PwC
58
年次
進展の概要
2017
• EMAは移転と英国のEU離脱に備え、2017年に事業継続計画(BCP)の第一段階を開始した。その結果、
一部の業務の優先順位が変更され、中断または延期され、ブレグジットへの準備活動と中核的業務の保護
にリソースが割り当てられることになった。特に優先されたのは、9月26日に開催された初の公聴会の準
備であった。このイベントには、バルプロ酸含有医薬品のリスクを最小限に抑える追加措置について話し合
うために、患者、介護者、医療従事者、その他の利害関係者が集まった。一般市民からの意見は、バルプロ
酸の評価を最終決定し、リスクのある女性を保護するための新たな措置を推奨する上で重要な役割を果た
した。その他の市民参加のハイライトには、以下のものがあった。
➢ レチノイドおよびバルプロ酸の評価期間中には、関係者との専用会議を通じて重要な意見も得られた。患者お
よび医療従事者は、PRACによる勧告作成を支援するために専門家の意見や経験を提供した。
➢ CHMPの口頭説明におけるベネフィット・リスクに関する議論に患者を関与させることに合意した。パイロット
版は終了し、報告書が公表された。EMAの管理委員会は、EMAの活動に若者を関与させる原則に合意した。
➢ EMAは、この分野において正式に前進した最初の医薬品規制当局のひとつであり、この重要な患者グループ
からの意見収集を促進する枠組みを提供している。
➢ 2016年のワークショップを基に、一般開業医を代表するさまざまなグループとのさらなる対話を行った。これ
は規制活動への関与を強化・改善することを目的とするものである。
➢ 患者および医療従事者を代表するEMAの委員会メンバーに対する、より合理化された効率的な支援が現在検
討されており、委員会内での役割遂行を支援することを目的とする。
➢ 既存の枠組みのポートフォリオを補完するものとして、EMAの管理委員会は学術機関との協力のための枠組
みを採択した。必要に応じて更新・改良される行動計画に従って、実施段階が開始された。
➢ 合計131人の患者が科学的助言手続きに参加し、その中には医療技術評価(HTA)機関との18件の共同助言
手続きも含まれている。
出典:Stakeholder Engagement report 2017 Patients, consumers, healthcare professionals, academics
and their organisations
PwC
58