よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (44 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
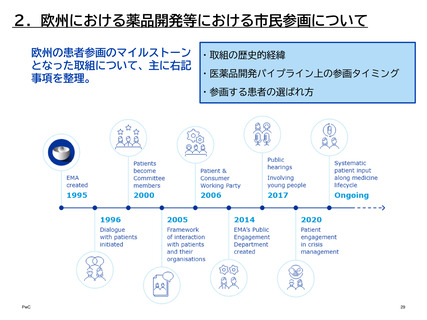
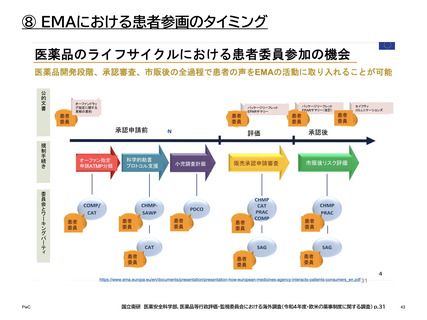
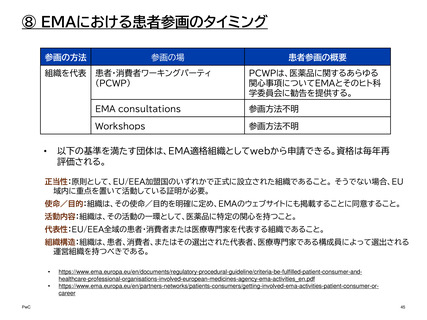
⑧ EMAにおける患者参画のタイミング
•
1.
2.
3.
4.
5.
6.
7.
PwC
患者、消費者、介護者は、活動の性質に応じて、欧州連合(EU)の患者および消費者団
体の代表、自身の団体の代表、または個人の専門家として関与できる。
参画の方法
参画の場
患者参画の概要
患者団体を代
表
経営委員会2
EMAの統合統治機関であり、予算および計画事項、事務局長
の任命、および庁の業績の監視に関する全般的な責任を負う
監督役を担う。年に4回の会合があり、患者団体の代表者2名
が委員として参画している。
科学委員会3
EMAには7つの科学委員会があり、うち4つの委員会で患者
代表が委員として参画している。
• 医薬品安全性リスク評価委員会(PRAC)4:患者団体の代
表1名と代理1名
• 希少疾病用医薬品委員会(COMP)5:患者団体代表3名
• 先進治療委員会(CAT)6:患者団体の代表2名と代理2名
• 小児委員会(PDCO)7:患者団体の代表3名と代理3名
https://www.ema.europa.eu/en/partners-networks/patients-consumers/getting-involved-ema-activities-patient-consumer-or-career
https://www.ema.europa.eu/en/about-us/who-we-are/management-board
https://www.ema.europa.eu/en/committees/how-committees-work
https://www.ema.europa.eu/en/committees/pharmacovigilance-risk-assessment-committee-prac
https://www.ema.europa.eu/en/committees/committee-orphan-medicinal-products-comp
https://www.ema.europa.eu/en/committees/committee-advanced-therapies-cat
https://www.ema.europa.eu/en/committees/paediatric-committee-pdco
44
•
1.
2.
3.
4.
5.
6.
7.
PwC
患者、消費者、介護者は、活動の性質に応じて、欧州連合(EU)の患者および消費者団
体の代表、自身の団体の代表、または個人の専門家として関与できる。
参画の方法
参画の場
患者参画の概要
患者団体を代
表
経営委員会2
EMAの統合統治機関であり、予算および計画事項、事務局長
の任命、および庁の業績の監視に関する全般的な責任を負う
監督役を担う。年に4回の会合があり、患者団体の代表者2名
が委員として参画している。
科学委員会3
EMAには7つの科学委員会があり、うち4つの委員会で患者
代表が委員として参画している。
• 医薬品安全性リスク評価委員会(PRAC)4:患者団体の代
表1名と代理1名
• 希少疾病用医薬品委員会(COMP)5:患者団体代表3名
• 先進治療委員会(CAT)6:患者団体の代表2名と代理2名
• 小児委員会(PDCO)7:患者団体の代表3名と代理3名
https://www.ema.europa.eu/en/partners-networks/patients-consumers/getting-involved-ema-activities-patient-consumer-or-career
https://www.ema.europa.eu/en/about-us/who-we-are/management-board
https://www.ema.europa.eu/en/committees/how-committees-work
https://www.ema.europa.eu/en/committees/pharmacovigilance-risk-assessment-committee-prac
https://www.ema.europa.eu/en/committees/committee-orphan-medicinal-products-comp
https://www.ema.europa.eu/en/committees/committee-advanced-therapies-cat
https://www.ema.europa.eu/en/committees/paediatric-committee-pdco
44