よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
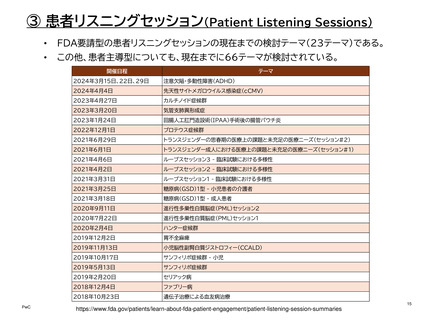
③ 患者リスニングセッション(Patient Listening Sessions)
患者リスニングセッションは、全米希少疾患患者協議会(NORD)とReagan-Udall
Foundationとの協力により、希少疾患患者の体験や緊急性の高いニーズを小グルー
プ、非公開の会議でFDA職員と共有し医薬品開発に役立てている。
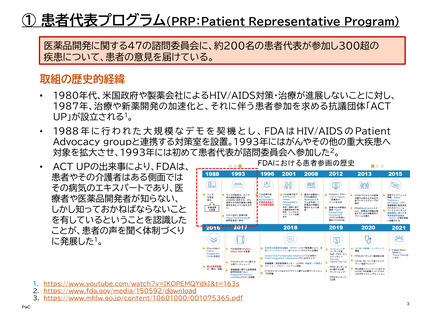
取組の歴史的経緯
•
全米希少疾患患者協議会(NORD)の協力のもと、FDAは2018年から患者リスニング
セッションのパイロットプログラムを開始した。
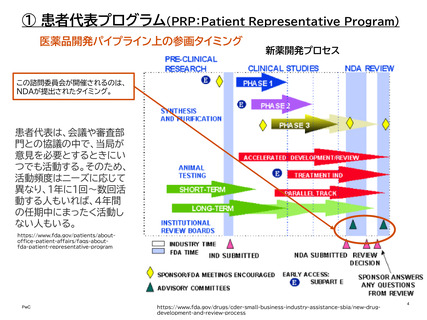
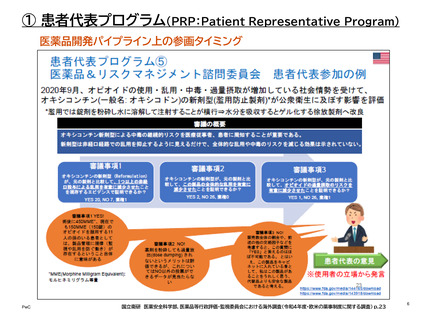
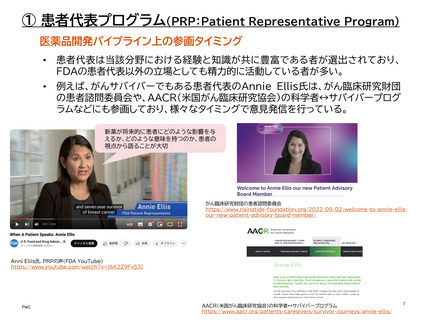
医薬品開発パイプライン上の参画タイミング
•
患者リスニングセッションは、FDAが特定の質問事項を用意する「FDA要請型」と、患者
団体が自らの見解をFDAと共有したい場合の「患者主導型」の2種類がある。
•
患者リスニングセッションは、小規模で非公式、非規制、非公開のディスカッションである。
最大1.5時間予定されており、FDAで直接か、電話で行うか、またはその両方で行うこと
ができる。
•
患者リスニングセッションは、特定の医療製品(医薬品、生物学的製剤、または医療機器)
ではなく、健康に関する経験や見解に関するものである。「FDAとの過去の会議や今後
の会議で予定されている議題と同じ議題ではない」という基準があり、リスニングセッ
ションで共有された情報は、(明言されてはいないが)参画タイミングとしては上流に位
置するものと考えられる。なお、患者リスニングセッションは、医薬品の審査プロセスには
関わっていない。
https://www.fda.gov/patients/learn-about-fda-patient-engagement/how-do-i-request-patient-listening-session
PwC
14
患者リスニングセッションは、全米希少疾患患者協議会(NORD)とReagan-Udall
Foundationとの協力により、希少疾患患者の体験や緊急性の高いニーズを小グルー
プ、非公開の会議でFDA職員と共有し医薬品開発に役立てている。
取組の歴史的経緯
•
全米希少疾患患者協議会(NORD)の協力のもと、FDAは2018年から患者リスニング
セッションのパイロットプログラムを開始した。
医薬品開発パイプライン上の参画タイミング
•
患者リスニングセッションは、FDAが特定の質問事項を用意する「FDA要請型」と、患者
団体が自らの見解をFDAと共有したい場合の「患者主導型」の2種類がある。
•
患者リスニングセッションは、小規模で非公式、非規制、非公開のディスカッションである。
最大1.5時間予定されており、FDAで直接か、電話で行うか、またはその両方で行うこと
ができる。
•
患者リスニングセッションは、特定の医療製品(医薬品、生物学的製剤、または医療機器)
ではなく、健康に関する経験や見解に関するものである。「FDAとの過去の会議や今後
の会議で予定されている議題と同じ議題ではない」という基準があり、リスニングセッ
ションで共有された情報は、(明言されてはいないが)参画タイミングとしては上流に位
置するものと考えられる。なお、患者リスニングセッションは、医薬品の審査プロセスには
関わっていない。
https://www.fda.gov/patients/learn-about-fda-patient-engagement/how-do-i-request-patient-listening-session
PwC
14