よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (62 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
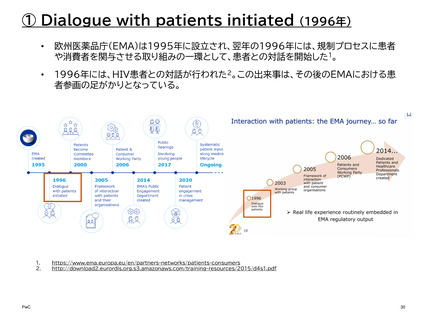
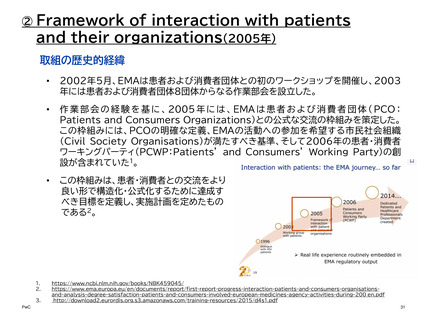
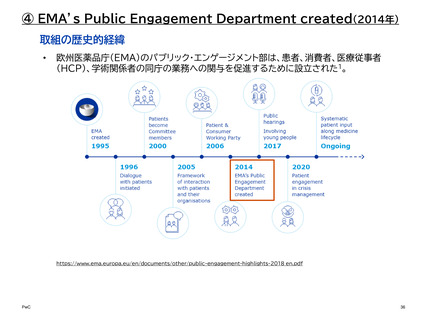
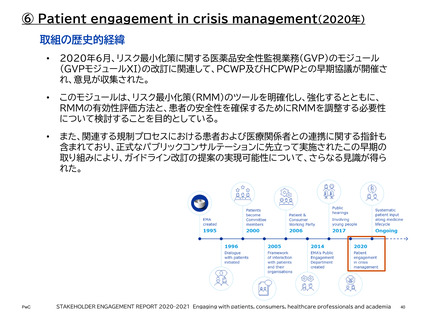
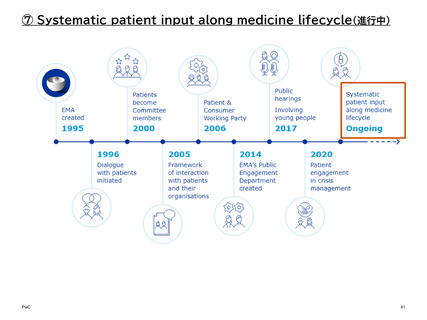
【参考】年報にみるEMAにおける患者参画の進展(2007~2023)
年次
進展の概要
2020
~
2021
• 2020年11月中旬、エマ・クック氏がEMAの執行役員に就任し、EMA初の女性トップとなった。2021年3
月には、患者・消費者作業部会(PCWP)と医療専門家作業部会(HCPWP)の合同会議で初めて演説を行
い、これらの利害関係者との継続的な関与に対する支持とコミットメントを表明しました。2020年はまた、
EMAの25周年記念の年でもあり、1995年以降の主なマイルストーンを強調するビデオが作成された。
• 2020年6月、リスク最小化策に関する医薬品安全性監視業務(GVP)のモジュール(GVPモジュールXI)
の改訂に関連して、PCWPおよびHCPWPとの早期協議が開催され、意見が収集された。このモジュール
は、リスク最小化策(RMM)のツールを明確化し、強化するとともに、RMMの有効性評価方法と、患者の安
全性を確保するためにRMMを調整する必要性について検討することを目的としている。また、関連する規
制プロセスにおける患者および医療関係者との連携に関する指針も含まれている。正式なパブリックコン
サルテーションに先立って実施されたこの早期の取り組みにより、ガイドライン改訂の提案の実現可能性に
ついて、さらなる見識が得られた。
• 「ICH E6(R3)医薬品の臨床試験実施に関する基準(GCP)」の改訂に関するワークショップが2020年6
月に開催された。このガイドラインは、臨床試験をグローバルに実施するための参考資料であり、その改訂
の目的は、臨床試験デザイン、データソース、臨床試験が実施されるさまざまな状況の多様性を認めること
にある。臨床試験に関わるステークホルダーが表明した主な懸念事項が改訂で確実に反映されるよう、患
者代表や学術臨床研究者の関与は不可欠である。また、新薬の開発、将来の臨床試験デザイン、将来のデー
タソースの利用を促進するために、ICH E8およびE6の改訂に関する最新情報も提供された。
• 2020年9月には、妊娠中および授乳中の医薬品のベネフィットとリスクに関するPCWPとHCPWPの合
同会議が開催された。欧州では、母体と乳児に対するベネフィットとリスクの理解が限られているため、妊
娠中または授乳中の女性に対して特別に承認された医薬品はごくわずかである。本ワークショップでは、妊
娠中および授乳中の女性を対象とした体系的なデータ収集と承認後のエビデンス生成におけるギャップに
対処する進行中のイニシアティブ(EUROmediCAT、Conception、CONSIGN)に関する情報が提供
され、今後、それらの取り組みを基盤としていくことが可能となる。参加者とパネリストの間で活発な議論
が行われたことは、妊娠中および授乳中の医薬品の有益性とリスクに関するより良い情報を得るための
EMAの戦略に貢献するものである。
出典:STAKEHOLDER ENGAGEMENT REPORT 2020–2021 Engaging with patients, consumers,
healthcare professionals and academia
PwC
62
年次
進展の概要
2020
~
2021
• 2020年11月中旬、エマ・クック氏がEMAの執行役員に就任し、EMA初の女性トップとなった。2021年3
月には、患者・消費者作業部会(PCWP)と医療専門家作業部会(HCPWP)の合同会議で初めて演説を行
い、これらの利害関係者との継続的な関与に対する支持とコミットメントを表明しました。2020年はまた、
EMAの25周年記念の年でもあり、1995年以降の主なマイルストーンを強調するビデオが作成された。
• 2020年6月、リスク最小化策に関する医薬品安全性監視業務(GVP)のモジュール(GVPモジュールXI)
の改訂に関連して、PCWPおよびHCPWPとの早期協議が開催され、意見が収集された。このモジュール
は、リスク最小化策(RMM)のツールを明確化し、強化するとともに、RMMの有効性評価方法と、患者の安
全性を確保するためにRMMを調整する必要性について検討することを目的としている。また、関連する規
制プロセスにおける患者および医療関係者との連携に関する指針も含まれている。正式なパブリックコン
サルテーションに先立って実施されたこの早期の取り組みにより、ガイドライン改訂の提案の実現可能性に
ついて、さらなる見識が得られた。
• 「ICH E6(R3)医薬品の臨床試験実施に関する基準(GCP)」の改訂に関するワークショップが2020年6
月に開催された。このガイドラインは、臨床試験をグローバルに実施するための参考資料であり、その改訂
の目的は、臨床試験デザイン、データソース、臨床試験が実施されるさまざまな状況の多様性を認めること
にある。臨床試験に関わるステークホルダーが表明した主な懸念事項が改訂で確実に反映されるよう、患
者代表や学術臨床研究者の関与は不可欠である。また、新薬の開発、将来の臨床試験デザイン、将来のデー
タソースの利用を促進するために、ICH E8およびE6の改訂に関する最新情報も提供された。
• 2020年9月には、妊娠中および授乳中の医薬品のベネフィットとリスクに関するPCWPとHCPWPの合
同会議が開催された。欧州では、母体と乳児に対するベネフィットとリスクの理解が限られているため、妊
娠中または授乳中の女性に対して特別に承認された医薬品はごくわずかである。本ワークショップでは、妊
娠中および授乳中の女性を対象とした体系的なデータ収集と承認後のエビデンス生成におけるギャップに
対処する進行中のイニシアティブ(EUROmediCAT、Conception、CONSIGN)に関する情報が提供
され、今後、それらの取り組みを基盤としていくことが可能となる。参加者とパネリストの間で活発な議論
が行われたことは、妊娠中および授乳中の医薬品の有益性とリスクに関するより良い情報を得るための
EMAの戦略に貢献するものである。
出典:STAKEHOLDER ENGAGEMENT REPORT 2020–2021 Engaging with patients, consumers,
healthcare professionals and academia
PwC
62