よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (64 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
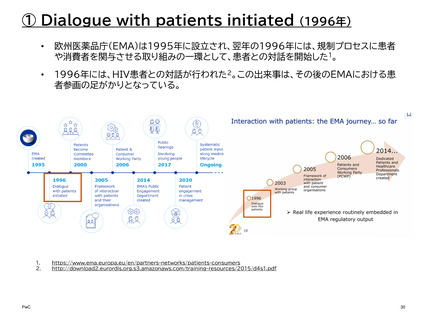
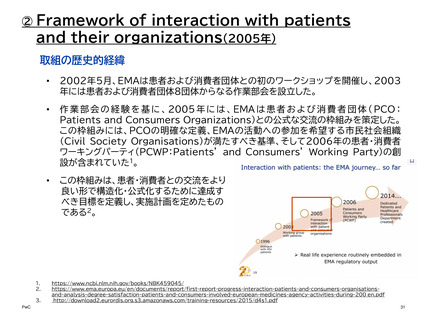
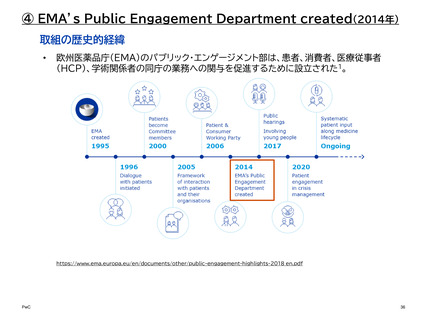
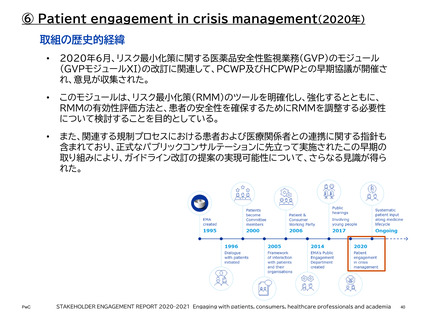
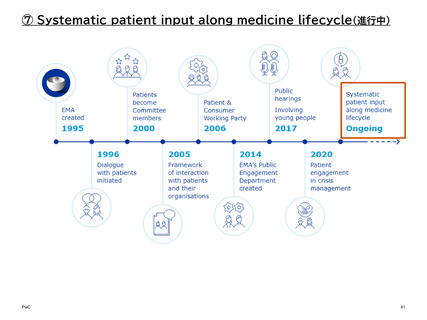
【参考】年報にみるEMAにおける患者参画の進展(2007~2023)
年次
進展の概要
2020
~
2021
• 2021年7月には、EMAが主催する形で、電子製品情報(ePI)に関する2回目のマルチステークホルダー
によるワークショップが開催された。EU共通基準の草案やePIの概念実証プロトタイプの開発など、プロ
ジェクトの成果物に関する最新情報が提供された。ワークショップの参加者のフィードバックと公開協議の
結果は、EU共通の電子基準とロードマップの最終版に反映され、これにより、将来的なユーザーのニーズ
を満たし、電子フォーマットでの製品情報へのアクセス、閲覧、および配信を可能にするプロジェクトとなる
ことが確実になる。
(続き)
• 2021年7月、EMAのPCWPとFDAのPECが初めて合同会議を開催し、それぞれがEMAとFDAの業務
に関与していることについて、意見や経験を交換した。PECはFDAとCTTIの協働イニシアティブであり、
EMAのPCWPをモデルとしている。PECの目的は、医薬品開発と規制に関する議論への患者の関与につ
いて話し合うことである。大西洋を挟んだ両グループの初の会合は、メンバーがバーチャルに集まり、患者
の関与に関する規制当局との協力や規制当局間の協力など、患者の関与に関する共通のトピックについて
話し合う機会となった。この初の会合が成功したことを受け、今後は毎年合同会議を開催することが合意
された。
• 多数の医薬品からニトロソアミン不純物が検出されたことを受け、2019年に実施された「教訓の抽出」作
業において、医療従事者および患者団体からEMAの広報活動に関するフィードバックが寄せられた。EMA
は現在、コミュニケーションに関する提言を実施しており、ニトロソアミンに関する情報を掲載した専用ウェ
ブページの開設など、いくつかの変更を行っている。EMAは、EU規制ネットワークのパートナーと協力し、
医薬品の品質を確保するとともに、利害関係者や一般市民へのニトロソアミン不純物に関するコミュニケー
ションの改善に努めている。
• 医療規制におけるビッグデータの利用拡大に向けた主要な提言を実施することを目的として、HMAEMA合同ビッグデータ運営委員会(BDSG)が設立された。2020年12月と2021年2月に開催された2
つのバーチャルなマルチステークホルダーワークショップでは、BDSGの患者中心の作業計画、進行中の活
動、および期待される成果(DARWIN EUなど)に関する最新情報が提供された。さまざまなステークホル
ダーグループのスピーカーがビッグデータに関する提言に対するフィードバックを提供し、その利点、課題、
協力の可能性について話し合った。患者や医療従事者を含むEUの主要ステークホルダーとの活発な対話
は、今後2年間の最優先事項のひとつであり、患者および医療従事者グループの代表者がBDSGおよび
DARWIN EU諮問委員会に任命された。
PwC
出典:STAKEHOLDER ENGAGEMENT REPORT 2020–2021 Engaging with patients, consumers,
healthcare professionals and academia
64
年次
進展の概要
2020
~
2021
• 2021年7月には、EMAが主催する形で、電子製品情報(ePI)に関する2回目のマルチステークホルダー
によるワークショップが開催された。EU共通基準の草案やePIの概念実証プロトタイプの開発など、プロ
ジェクトの成果物に関する最新情報が提供された。ワークショップの参加者のフィードバックと公開協議の
結果は、EU共通の電子基準とロードマップの最終版に反映され、これにより、将来的なユーザーのニーズ
を満たし、電子フォーマットでの製品情報へのアクセス、閲覧、および配信を可能にするプロジェクトとなる
ことが確実になる。
(続き)
• 2021年7月、EMAのPCWPとFDAのPECが初めて合同会議を開催し、それぞれがEMAとFDAの業務
に関与していることについて、意見や経験を交換した。PECはFDAとCTTIの協働イニシアティブであり、
EMAのPCWPをモデルとしている。PECの目的は、医薬品開発と規制に関する議論への患者の関与につ
いて話し合うことである。大西洋を挟んだ両グループの初の会合は、メンバーがバーチャルに集まり、患者
の関与に関する規制当局との協力や規制当局間の協力など、患者の関与に関する共通のトピックについて
話し合う機会となった。この初の会合が成功したことを受け、今後は毎年合同会議を開催することが合意
された。
• 多数の医薬品からニトロソアミン不純物が検出されたことを受け、2019年に実施された「教訓の抽出」作
業において、医療従事者および患者団体からEMAの広報活動に関するフィードバックが寄せられた。EMA
は現在、コミュニケーションに関する提言を実施しており、ニトロソアミンに関する情報を掲載した専用ウェ
ブページの開設など、いくつかの変更を行っている。EMAは、EU規制ネットワークのパートナーと協力し、
医薬品の品質を確保するとともに、利害関係者や一般市民へのニトロソアミン不純物に関するコミュニケー
ションの改善に努めている。
• 医療規制におけるビッグデータの利用拡大に向けた主要な提言を実施することを目的として、HMAEMA合同ビッグデータ運営委員会(BDSG)が設立された。2020年12月と2021年2月に開催された2
つのバーチャルなマルチステークホルダーワークショップでは、BDSGの患者中心の作業計画、進行中の活
動、および期待される成果(DARWIN EUなど)に関する最新情報が提供された。さまざまなステークホル
ダーグループのスピーカーがビッグデータに関する提言に対するフィードバックを提供し、その利点、課題、
協力の可能性について話し合った。患者や医療従事者を含むEUの主要ステークホルダーとの活発な対話
は、今後2年間の最優先事項のひとつであり、患者および医療従事者グループの代表者がBDSGおよび
DARWIN EU諮問委員会に任命された。
PwC
出典:STAKEHOLDER ENGAGEMENT REPORT 2020–2021 Engaging with patients, consumers,
healthcare professionals and academia
64