よむ、つかう、まなぶ。
【資料3-2】医薬品等行政評価・監視委員会における海外調査(FDA、EMAにおける患者、市民参画の取組)[3.8MB] (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
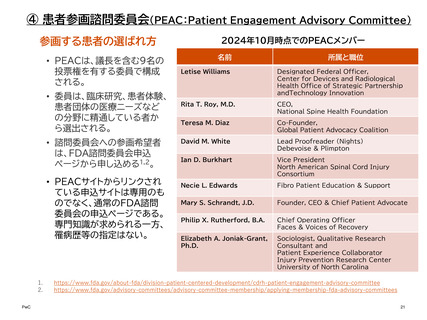
④ 患者参画諮問委員会(PEAC:Patient Engagement Advisory Committee)
医薬品開発パイプライン上の参画タイミング
•
PEACは、医療機器の規制・使用に関する諮問委員会である。特定の医療機器の開発に関
与するわけではないが、患者の声を生かしたガイダンスの制定等に寄与している。
•
また、以下のような議題についてCDRHに助言を行うことがある。
➢
➢
➢
➢
➢
➢
機関の指針および方針
臨床研究の設計
実世界データ
患者からの意見の科学
医療機器の利点およびリスクの伝達
デジタルヘルス技術
PEACの過去の議題
2023年:医療機器における健康の公平性の向上
2022年:拡張現実と仮想現実の医療機器
2021年:医療機器のリコール:患者中心のコミュニケーション
2020年:医療機器における人工知能(AI)と機械学習(ML)
2019年:医療機器におけるサイバーセキュリティ
2018年:患者が生成した健康データ
2017年:医療機器の臨床試験における患者の関与
https://www.fda.gov/about-fda/division-patient-centered-development/cdrh-patient-engagement-advisory-committee
PwC
18
医薬品開発パイプライン上の参画タイミング
•
PEACは、医療機器の規制・使用に関する諮問委員会である。特定の医療機器の開発に関
与するわけではないが、患者の声を生かしたガイダンスの制定等に寄与している。
•
また、以下のような議題についてCDRHに助言を行うことがある。
➢
➢
➢
➢
➢
➢
機関の指針および方針
臨床研究の設計
実世界データ
患者からの意見の科学
医療機器の利点およびリスクの伝達
デジタルヘルス技術
PEACの過去の議題
2023年:医療機器における健康の公平性の向上
2022年:拡張現実と仮想現実の医療機器
2021年:医療機器のリコール:患者中心のコミュニケーション
2020年:医療機器における人工知能(AI)と機械学習(ML)
2019年:医療機器におけるサイバーセキュリティ
2018年:患者が生成した健康データ
2017年:医療機器の臨床試験における患者の関与
https://www.fda.gov/about-fda/division-patient-centered-development/cdrh-patient-engagement-advisory-committee
PwC
18