よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
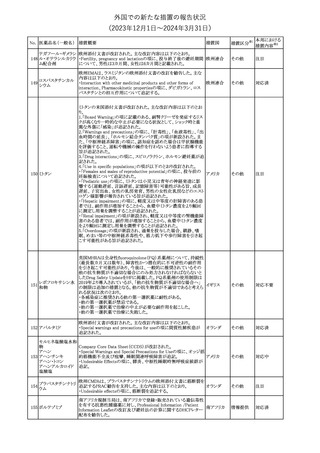
令和6年6月19日
令和6年度第1回
医薬品等安全対策部会
外国での新たな措置の報告状況
資料3-3
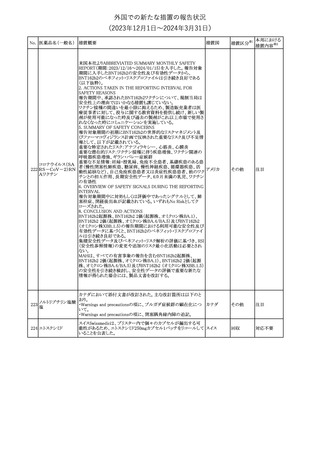
(2023年12⽉1⽇〜2024年3⽉31⽇)
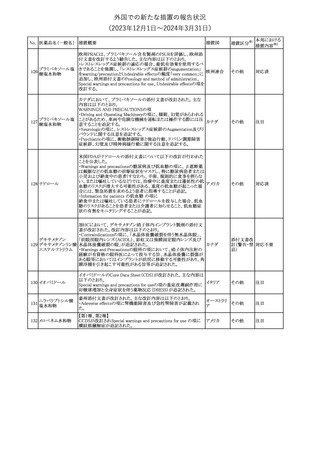
措置区分※1
本邦における
措置内容※2
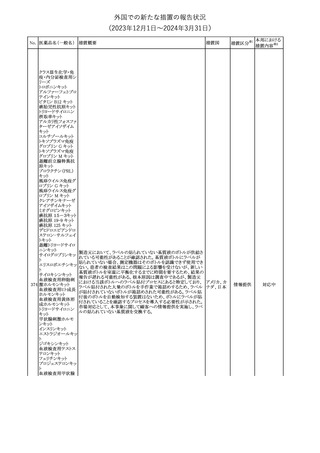
米国添付文書が改訂された。
・Warnings and Precautionsの項に、互換性のない自動注射器を使
1 グラチラマー酢酸塩 用すると、投与漏れや部分投与などの投薬ミスのリスクが高まる可能 アメリカ
性があるため、自動注射器のラベルを参照し、グラチラマー酢酸塩
製品に適合していることを確認するよう追記された。
その他
対応済
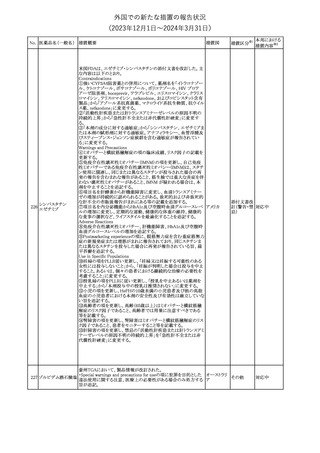
【第1,2報】
米国添付文書のBox warning、Warnings and precautions、Patient
counseling information、Ultomiris REMSの項について、本剤使用前
のワクチン接種の必要性を強調する改訂を行うよう、米FDAより製造 アメリカ
販売業者にレターが発出された。
【第3報】
第1及び2報のFDAの指示に従い、米国添付文書が改訂された。
その他
対応済
その他
注目
豪州TGAは、デュロキセチン含有医薬品中の低レベルのニトロソア
ミン不純物(N-nitroso-duloxetine[NDLX])の存在について調査を
行っている。豪州のデュロキセチン製品の製造業者の一部は、自社
製品に許容摂取量(AI)の限度を超えるレベルのNDLXが含まれて
オーストラリ
デュロキセチン塩酸
4
いると報告している。TGAは、これら医薬品の短期使用に関連する
その他
塩
ア
健康上の懸念は無いと判断し、患者がこれら医薬品に引き続きアク
セスできるようにAIのレベルを超える微量のNDLXを含むデュロキセ
チン製品の供給を一時的に製造業者に許可するとともに、製造及
び検査プロセス改善の実施を監視している。
注目
【第1報】【第2報】
製造元における苦情調査の結果、当該製品の対象ロットにおいて、
一部の試薬カートリッジで発光強度の低下が確認された。問題の試
薬カートリッジを使用した場合、コントロールが管理範囲を外れる、あ
るいは、特定条件下で誤った患者検体の測定結果が得られる可能
性がある。 当該製品は、電子添文に従い各測定日(24時間ごと)にコ
ントロール測定が行われるが、キャリブレーションやコントロール測定
のタイミング等により、誤った測定結果が得られる可能性がある。 対
象ロットの使用中止と廃棄について、顧客に対し情報提供を実施す
る。
オーストラリ
【第3報】
ア、
海外製造所及び国内における調査の結果、製造工程における問題
アメリカ、
B型肝炎ウイルス表
は認められなかった。当該ロットの製品試験、安定性試験、参考品
情報提供
5
面抗原キット
日本、
を用いた試験において問題は認められず、製品性能や安定性に関
欧州連合、
して問題ないことが示された。一部の苦情現品で構成試薬ボトルの
カナダ
物理的な膨張が観察されたため製造元で熱負荷に対する調査が実
施された結果、高温負荷により膨張及び性能への悪影響が示され
た。当該事象は、何等かの要因により一部の試薬カートリッジに高温
負荷等がかかり影響が生じた可能性があると推察されるが、原因を
裏付ける客観的な事実はなく、特定に至らなかった。当該事象の根
本原因は特定されなかったため、原因に基づく特定の是正措置は
設定されなかったが、製造、試験、苦情、流通に係る人員に当該事
象を共有し、認識の周知が行われた。製造元の品質マネジメントシ
ステムに従い、当該事象の発生動向を監視し、必要に応じて詳細調
査の実施、それに基づく措置が講じられる。
対応不要
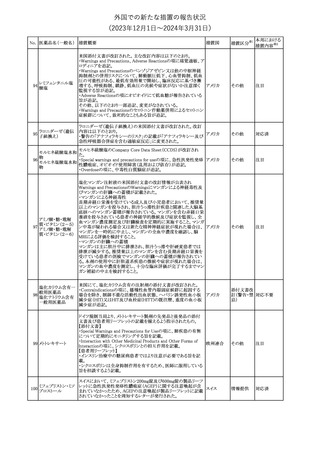
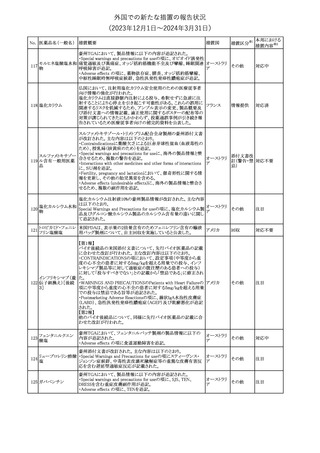
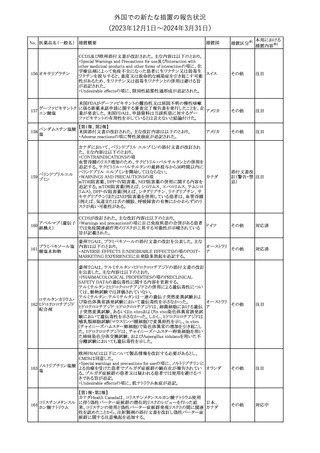
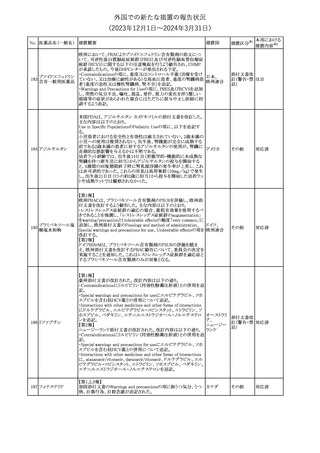
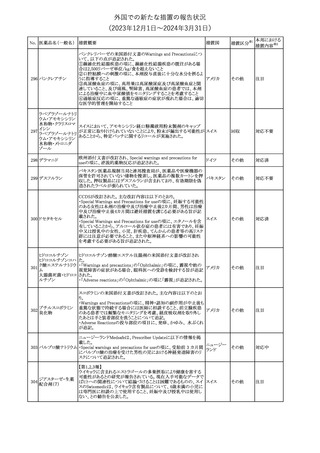
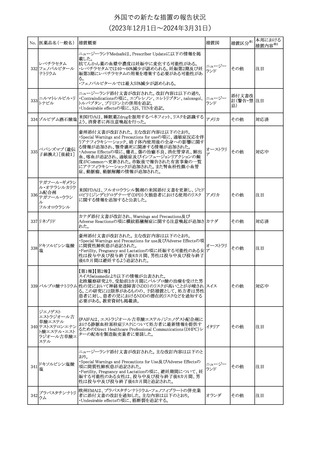
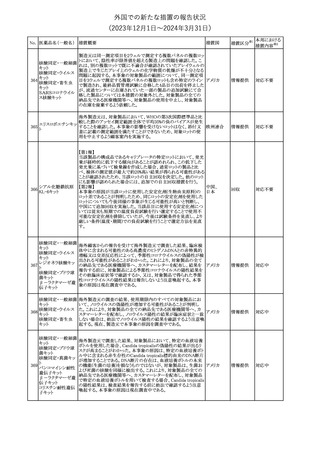
No. 医薬品名(一般名) 措置概要
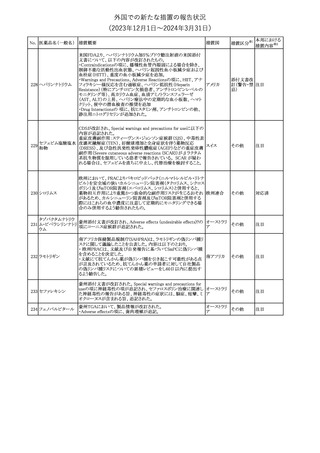
2
ラブリズマブ(遺伝
子組換え)
措置国
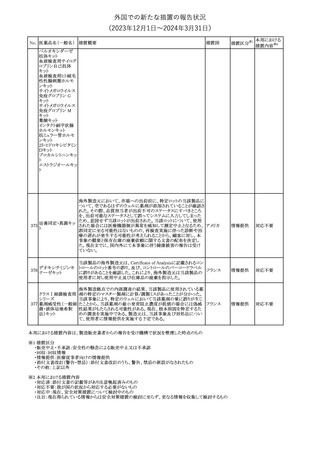
欧州CMDhは、以下の情報を公表した。
・精神科医の知識不足、妊娠中の使用の禁忌に関する一般開業医
の混乱を考慮し、欧州添付文書Fertility, pregnancy and lactationの
3 バルプロ酸ナトリウム
欧州連合
上部に適応症ごとの禁忌の枠囲み表示を追加する。
・バルプロ酸のリスク、催奇形性及び神経発達障害に関する知識を
さらに高めるために、患者と医療従事者向けのガイドが改訂される。
6
エクリズマブ(遺伝
子組換え)
【第1,2報】
米国添付文書のBox warning、Warnings and precautions、Patient
counseling information、Soliris REMSの項について、本剤使用前の
ワクチン接種の必要性を強調する改訂を行うよう、米FDAより製造販 アメリカ
売業者にレターが発出された。
【第3報】
第1及び2報のFDAの指示に従い、米国添付文書が改訂された。
1
その他
対応済
令和6年度第1回
医薬品等安全対策部会
外国での新たな措置の報告状況
資料3-3
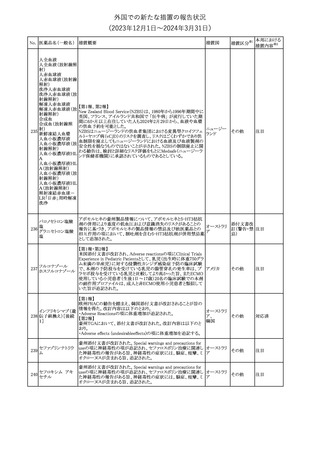
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
米国添付文書が改訂された。
・Warnings and Precautionsの項に、互換性のない自動注射器を使
1 グラチラマー酢酸塩 用すると、投与漏れや部分投与などの投薬ミスのリスクが高まる可能 アメリカ
性があるため、自動注射器のラベルを参照し、グラチラマー酢酸塩
製品に適合していることを確認するよう追記された。
その他
対応済
【第1,2報】
米国添付文書のBox warning、Warnings and precautions、Patient
counseling information、Ultomiris REMSの項について、本剤使用前
のワクチン接種の必要性を強調する改訂を行うよう、米FDAより製造 アメリカ
販売業者にレターが発出された。
【第3報】
第1及び2報のFDAの指示に従い、米国添付文書が改訂された。
その他
対応済
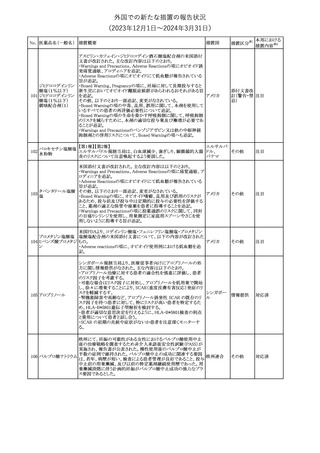
その他
注目
豪州TGAは、デュロキセチン含有医薬品中の低レベルのニトロソア
ミン不純物(N-nitroso-duloxetine[NDLX])の存在について調査を
行っている。豪州のデュロキセチン製品の製造業者の一部は、自社
製品に許容摂取量(AI)の限度を超えるレベルのNDLXが含まれて
オーストラリ
デュロキセチン塩酸
4
いると報告している。TGAは、これら医薬品の短期使用に関連する
その他
塩
ア
健康上の懸念は無いと判断し、患者がこれら医薬品に引き続きアク
セスできるようにAIのレベルを超える微量のNDLXを含むデュロキセ
チン製品の供給を一時的に製造業者に許可するとともに、製造及
び検査プロセス改善の実施を監視している。
注目
【第1報】【第2報】
製造元における苦情調査の結果、当該製品の対象ロットにおいて、
一部の試薬カートリッジで発光強度の低下が確認された。問題の試
薬カートリッジを使用した場合、コントロールが管理範囲を外れる、あ
るいは、特定条件下で誤った患者検体の測定結果が得られる可能
性がある。 当該製品は、電子添文に従い各測定日(24時間ごと)にコ
ントロール測定が行われるが、キャリブレーションやコントロール測定
のタイミング等により、誤った測定結果が得られる可能性がある。 対
象ロットの使用中止と廃棄について、顧客に対し情報提供を実施す
る。
オーストラリ
【第3報】
ア、
海外製造所及び国内における調査の結果、製造工程における問題
アメリカ、
B型肝炎ウイルス表
は認められなかった。当該ロットの製品試験、安定性試験、参考品
情報提供
5
面抗原キット
日本、
を用いた試験において問題は認められず、製品性能や安定性に関
欧州連合、
して問題ないことが示された。一部の苦情現品で構成試薬ボトルの
カナダ
物理的な膨張が観察されたため製造元で熱負荷に対する調査が実
施された結果、高温負荷により膨張及び性能への悪影響が示され
た。当該事象は、何等かの要因により一部の試薬カートリッジに高温
負荷等がかかり影響が生じた可能性があると推察されるが、原因を
裏付ける客観的な事実はなく、特定に至らなかった。当該事象の根
本原因は特定されなかったため、原因に基づく特定の是正措置は
設定されなかったが、製造、試験、苦情、流通に係る人員に当該事
象を共有し、認識の周知が行われた。製造元の品質マネジメントシ
ステムに従い、当該事象の発生動向を監視し、必要に応じて詳細調
査の実施、それに基づく措置が講じられる。
対応不要
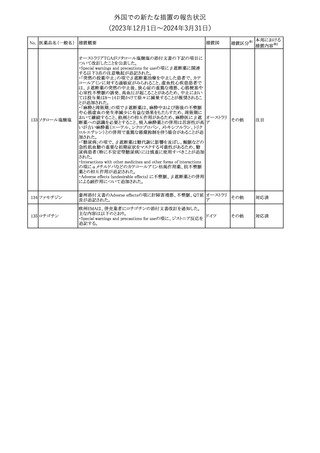
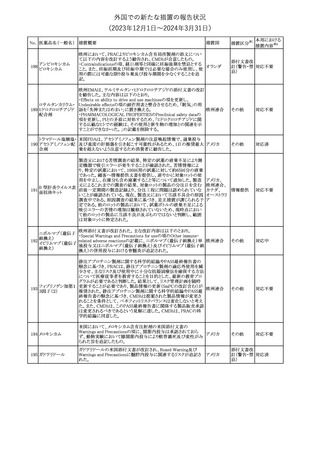
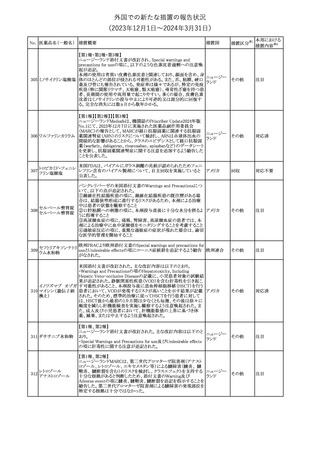
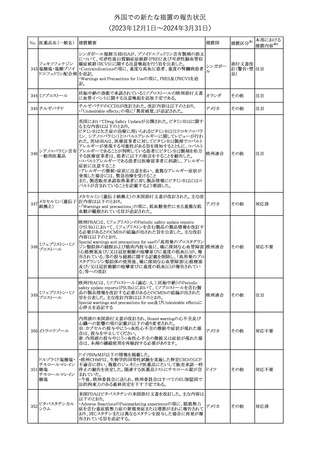
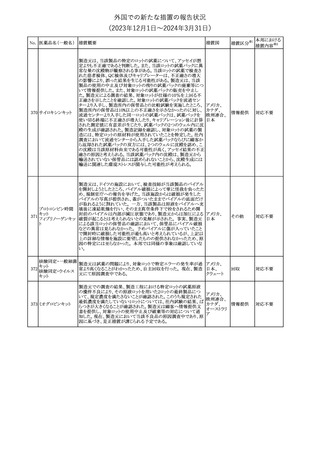
No. 医薬品名(一般名) 措置概要
2
ラブリズマブ(遺伝
子組換え)
措置国
欧州CMDhは、以下の情報を公表した。
・精神科医の知識不足、妊娠中の使用の禁忌に関する一般開業医
の混乱を考慮し、欧州添付文書Fertility, pregnancy and lactationの
3 バルプロ酸ナトリウム
欧州連合
上部に適応症ごとの禁忌の枠囲み表示を追加する。
・バルプロ酸のリスク、催奇形性及び神経発達障害に関する知識を
さらに高めるために、患者と医療従事者向けのガイドが改訂される。
6
エクリズマブ(遺伝
子組換え)
【第1,2報】
米国添付文書のBox warning、Warnings and precautions、Patient
counseling information、Soliris REMSの項について、本剤使用前の
ワクチン接種の必要性を強調する改訂を行うよう、米FDAより製造販 アメリカ
売業者にレターが発出された。
【第3報】
第1及び2報のFDAの指示に従い、米国添付文書が改訂された。
1
その他
対応済