よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
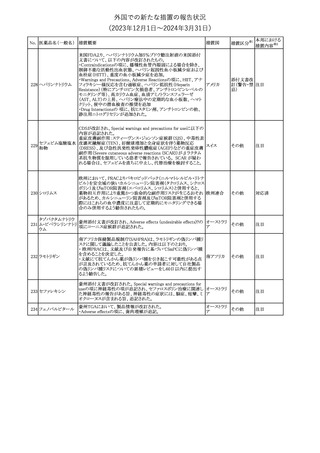
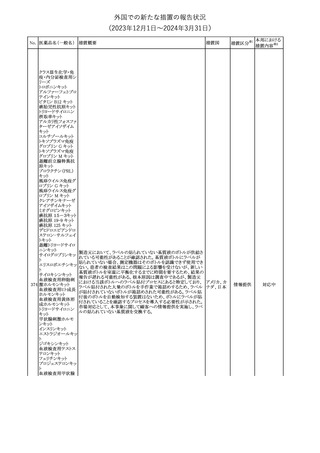
米国本社よりABBREVIATED SUMMARY MONTHLY SAFETY
REPORT(期間:2023/10/16~2023/11/15)を入手した。報告対象
期間に入手したBNT162b2の安全性及び有効性データから、
BNT162b2のベネフィット・リスクプロファイルは引き続き良好である
(以下抜粋)。
2. ACTIONS TAKEN IN THE REPORTING INTERVAL FOR
SAFETY REASONS
報告期間中、承認された起源株、オミクロン株(BA.1、BA.4-5)対応
ワクチンについて、規制当局は安全性上の理由ではいかなる措置も
講じていない。
ワクチン接種の間違いを最小限に抑えるため、製造販売業者は医
療従事者に対して、投与に関する教育資料を提供し続け、新しい製
剤が使用可能になった時及び過去の製剤がこれ以上市場で使用さ
れなくなった時にコミュニケーションを実施している。
5. SUMMARY OF SAFETY CONCERNS
報告対象期間の初期にBNT162b2の世界的なリスクマネジメント及
びファーマコビジランス計画で反映された重要なリスク及び不足情
報として、以下が記載されている。
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜炎
重要な潜在的リスク:ワクチン接種に伴う疾患増強、ワクチン関連の
呼吸器疾患増強、ギラン・バレー症候群
コロナウイルス(SA
重要な不足情報:妊婦・授乳婦、免疫不全患者、基礎疾患のある患
67 RS-CoV-2)RN
アメリカ
者(慢性閉塞性肺疾患、糖尿病、慢性神経疾患、循環器疾患、活
Aワクチン
動性結核など)、自己免疫疾患患者又は炎症性疾患患者、他のワク
チンとの相互作用、長期安全性データ、6カ月未満の乳児、ワクチン
の有効性
6. OVERVIEW OF SAFETY SIGNALS DURING THE REPORTING
INTERVAL
報告対象期間中に評価中であったシグナルとして、肺塞栓症、閉経
後出血が記載されている。
8. CONCLUSION AND ACTIONS
BNT162b2起源株、BNT162b2 2価(起源株、オミクロン株BA.1)、
BNT162b2 2価(起源株、オミクロン株BA.4/BA.5)及びBNT162b2
(オミクロン株XBB.1.5)の報告期間における利用可能な安全性及び
有効性データに基づくと、BNT162b2のベネフィット・リスクプロファイ
ルは引き続き良好である。
集積安全性データ及びベネフィット・リスク解析の評価に基づき、RSI
(安全性参照情報)の変更や追加のリスク最小化活動は必要とされ
ない。
MAHは、すべての有害事象の報告を含むBNT162b2起源株、
BNT162b2 2価(起源株、オミクロン株BA.1)、BNT162b2 2価(起源
株、オミクロン株BA.4/BA.5)及びBNT162b2 (オミクロン株XBB.1.5)
の安全性を引き続き検討し、安全性データの評価で重要な新たな
情報が得られた場合には、製品文書を改訂する。
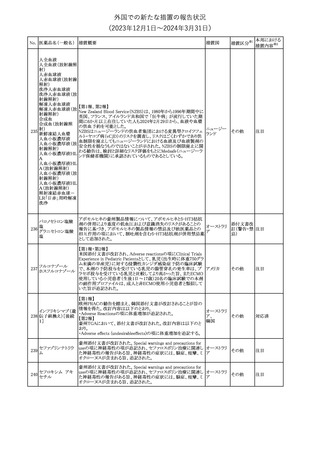
その他
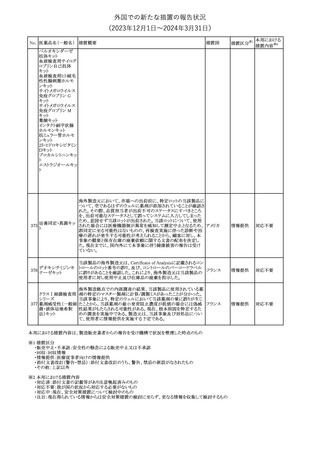
注目
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Warnings and Precautions、Adverse Reactionsの項に重篤な胃腸
アメリカ
障害が追記。
・Adverse Reactionsの項に消化管穿孔、潰瘍、閉塞、出血が追記。
その他
注目
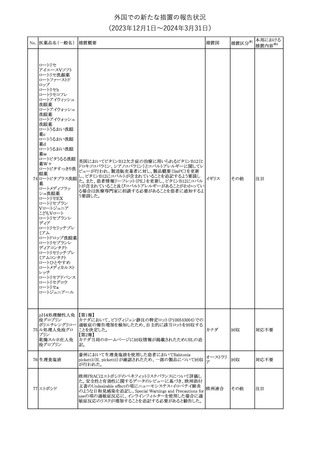
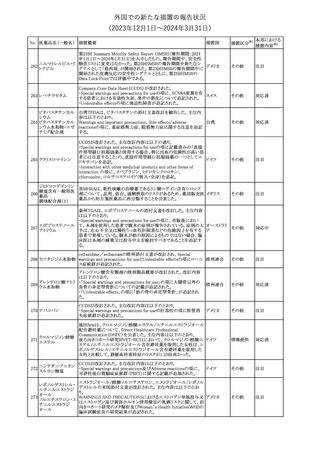
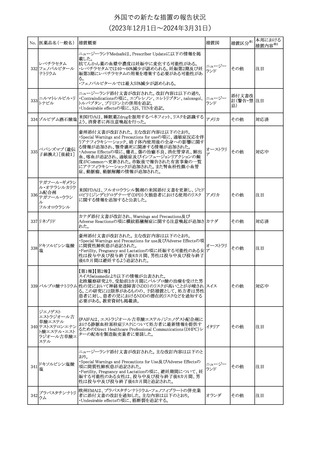
No. 医薬品名(一般名) 措置概要
68 フマル酸ジメチル
措置国
11
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
米国本社よりABBREVIATED SUMMARY MONTHLY SAFETY
REPORT(期間:2023/10/16~2023/11/15)を入手した。報告対象
期間に入手したBNT162b2の安全性及び有効性データから、
BNT162b2のベネフィット・リスクプロファイルは引き続き良好である
(以下抜粋)。
2. ACTIONS TAKEN IN THE REPORTING INTERVAL FOR
SAFETY REASONS
報告期間中、承認された起源株、オミクロン株(BA.1、BA.4-5)対応
ワクチンについて、規制当局は安全性上の理由ではいかなる措置も
講じていない。
ワクチン接種の間違いを最小限に抑えるため、製造販売業者は医
療従事者に対して、投与に関する教育資料を提供し続け、新しい製
剤が使用可能になった時及び過去の製剤がこれ以上市場で使用さ
れなくなった時にコミュニケーションを実施している。
5. SUMMARY OF SAFETY CONCERNS
報告対象期間の初期にBNT162b2の世界的なリスクマネジメント及
びファーマコビジランス計画で反映された重要なリスク及び不足情
報として、以下が記載されている。
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜炎
重要な潜在的リスク:ワクチン接種に伴う疾患増強、ワクチン関連の
呼吸器疾患増強、ギラン・バレー症候群
コロナウイルス(SA
重要な不足情報:妊婦・授乳婦、免疫不全患者、基礎疾患のある患
67 RS-CoV-2)RN
アメリカ
者(慢性閉塞性肺疾患、糖尿病、慢性神経疾患、循環器疾患、活
Aワクチン
動性結核など)、自己免疫疾患患者又は炎症性疾患患者、他のワク
チンとの相互作用、長期安全性データ、6カ月未満の乳児、ワクチン
の有効性
6. OVERVIEW OF SAFETY SIGNALS DURING THE REPORTING
INTERVAL
報告対象期間中に評価中であったシグナルとして、肺塞栓症、閉経
後出血が記載されている。
8. CONCLUSION AND ACTIONS
BNT162b2起源株、BNT162b2 2価(起源株、オミクロン株BA.1)、
BNT162b2 2価(起源株、オミクロン株BA.4/BA.5)及びBNT162b2
(オミクロン株XBB.1.5)の報告期間における利用可能な安全性及び
有効性データに基づくと、BNT162b2のベネフィット・リスクプロファイ
ルは引き続き良好である。
集積安全性データ及びベネフィット・リスク解析の評価に基づき、RSI
(安全性参照情報)の変更や追加のリスク最小化活動は必要とされ
ない。
MAHは、すべての有害事象の報告を含むBNT162b2起源株、
BNT162b2 2価(起源株、オミクロン株BA.1)、BNT162b2 2価(起源
株、オミクロン株BA.4/BA.5)及びBNT162b2 (オミクロン株XBB.1.5)
の安全性を引き続き検討し、安全性データの評価で重要な新たな
情報が得られた場合には、製品文書を改訂する。
その他
注目
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Warnings and Precautions、Adverse Reactionsの項に重篤な胃腸
アメリカ
障害が追記。
・Adverse Reactionsの項に消化管穿孔、潰瘍、閉塞、出血が追記。
その他
注目
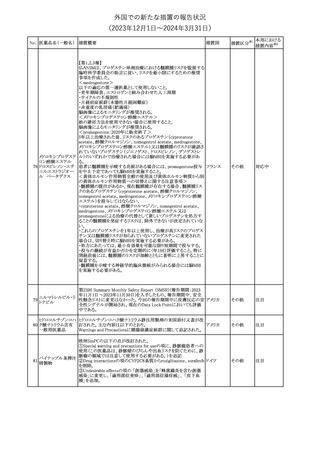
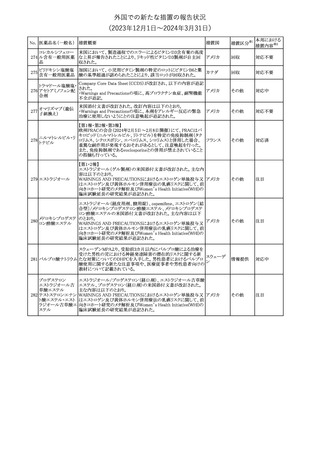
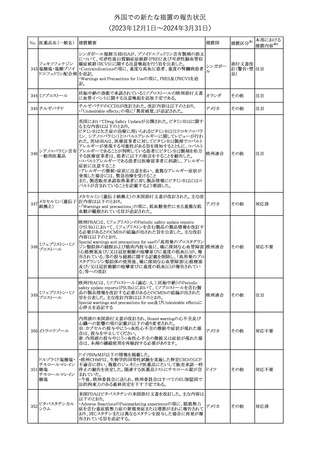
No. 医薬品名(一般名) 措置概要
68 フマル酸ジメチル
措置国
11