よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
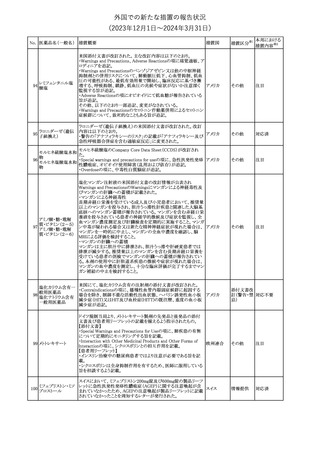
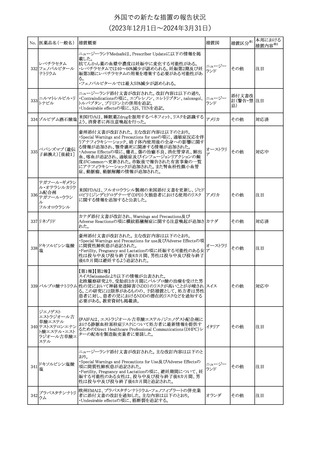
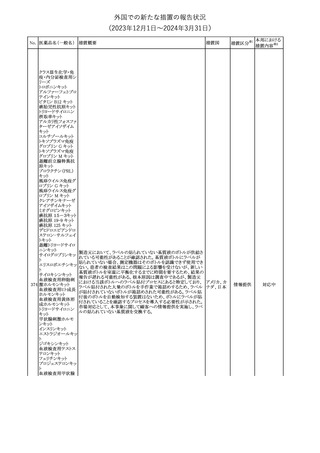
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
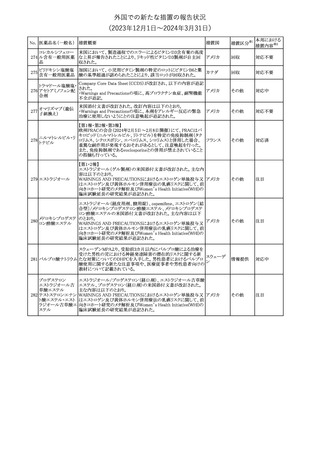
措置区分※1
本邦における
措置内容※2
米国本社よりABBREVIATED SUMMARY MONTHLY SAFETY
REPORT(期間:2023/11/16~2023/12/15)を入手した。報告対象
期間に入手したBNT162b2の安全性及び有効性データから、
BNT162b2のベネフィット・リスクプロファイルは引き続き良好である
(以下抜粋)。
2. ACTIONS TAKEN IN THE REPORTING INTERVAL FOR
SAFETY REASONS
報告期間中、承認された以下のBNT162b2ワクチンについて、規制
当局は安全性上の理由ではいかなる措置も講じていない。
ワクチン接種の間違いを最小限に抑えるため、製造販売業者は医
療従事者に対して、投与に関する教育資料を提供し続け、新しい製
剤が使用可能になった時及び過去の製剤がこれ以上市場で使用さ
れなくなった時にコミュニケーションを実施している。
5. SUMMARY OF SAFETY CONCERNS
Table 10は報告対象期間の初期にBNT162b2の世界的なリスクマネ
ジメント及びファーマコヴィジランス計画で反映された重要なリスク及
び不足情報を要約した総合的なリストである。
重要な特定されたリスク:Anaphylaxis、Myocarditis and Pericarditis
重要な潜在的リスク:Vaccine-Associated Enhanced Disease
(VAED) including Vaccine-Associated Enhanced Respiratory
Disease (VAERD)、Guillain-Barre syndrome
不足情報: Use in Pregnancy and While Breast Feeding、Use in
Immunocompromised Patients、Use in Frail Patients With Coコロナウイルス(SA
Morbidities (e.g. COPD, Diabetes, Chronic Neurological Disease,
136 RS-CoV-2)RN
アメリカ
Cardiovascular disorders, Active tuberculosis)、Use in Patients
Aワクチン
With Autoimmune or Inflammatory Disorders、Interaction With
Other Vaccines、Long-Term Safety Data、Use in Pediatric
Individuals less than 6 Months of Age、Vaccine Effectiveness
6. OVERVIEW OF SAFETY SIGNALS DURING THE REPORTING
INTERVAL
Overview of Signals(Table 11)は報告対象期間中に対処もしくは評
価中であったシグナルである。
Pulmonary Embolism (PE)(Ongoing、N/A)、Post-Menopausal
Haemorrhage (PMH) (Ongoing、N/A)が記載されている。
8. CONCLUSION AND ACTIONS
BNT162b2起源株、BNT162b2 2価(起源株、オミクロン株BA.1)、
BNT162b2 2価(起源株、オミクロン株BA.4/BA.5)及びBNT162b2
(オミクロン株XBB.1.5)の報告期間における利用可能な安全性及び
有効性データに基づくと、BNT162b2のベネフィット・リスクプロファイ
ルは引き続き良好である。
集積安全性データ及びベネフィット・リスク解析の評価に基づき、RSI
(安全性参照情報)の変更や追加のリスク最小化活動は必要とされ
ない。
MAHは、すべての有害事象の報告を含むBNT162b2起源株、
BNT162b2 2価(起源株、オミクロン株BA.1)、BNT162b2 2価(起源
株、オミクロン株BA.4/BA.5)及びBNT162b2 (オミクロン株XBB.1.5)
の安全性を引き続き検討し、安全性データの評価で重要な新たな
情報が得られた場合には、製品文書を改訂する。
その他
注目
欧州PRACは、バルプロ酸による治療を受けている男性患者に対し
て予防措置を採ることを推奨している。この措置は妊娠前3カ月間に
バルプロ酸による治療を受けた男性患者を親とする児に認められた
神経発達障害の潜在的リスクに対応するものである。
医師はバルプロ酸を使用している男性患者に対し、当該情報を提
137 バルプロ酸ナトリウム
欧州連合
供し、男性患者及びパートナーの女性に適切な避妊について検討
する必要があることを伝えるべきである。また、バルプロ酸による治
療が男性患者にとって最も適切な治療法であるのか、定期的に確
認すべきであり、特に子供を持つことを計画している場合には確認
が重要である。
その他
対応中
独BfArMは以下の情報を公表した。
138 バルプロ酸ナトリウム ・欧州PRACがバルプロ酸による治療を受けている男性患者に対し
て予防措置を採ることを推奨している。
その他
対応中
その他
対応中
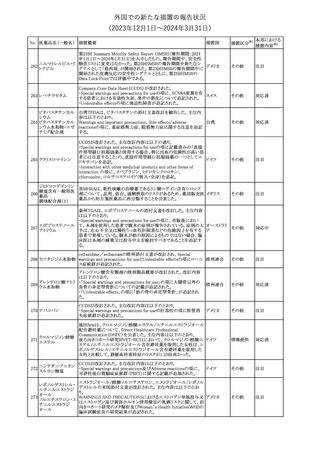
No. 医薬品名(一般名) 措置概要
措置国
ドイツ
英MHRAは、妊娠前3カ月間にバルプロ酸による治療を受けた男性
139 バルプロ酸ナトリウム 患者を親とする児における神経発達障害の潜在的リスクに関して、 イギリス
研究結果の修正を受領し、分析が実施されていることを公表した。
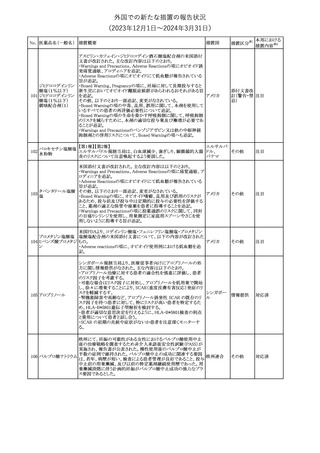
26
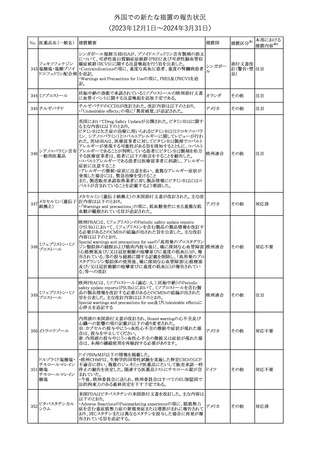
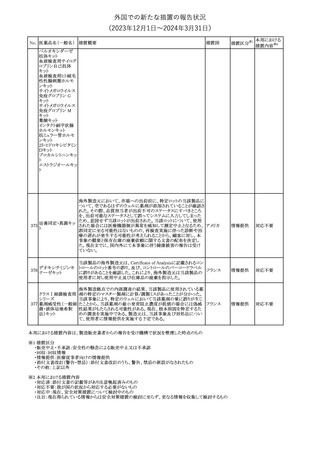
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
米国本社よりABBREVIATED SUMMARY MONTHLY SAFETY
REPORT(期間:2023/11/16~2023/12/15)を入手した。報告対象
期間に入手したBNT162b2の安全性及び有効性データから、
BNT162b2のベネフィット・リスクプロファイルは引き続き良好である
(以下抜粋)。
2. ACTIONS TAKEN IN THE REPORTING INTERVAL FOR
SAFETY REASONS
報告期間中、承認された以下のBNT162b2ワクチンについて、規制
当局は安全性上の理由ではいかなる措置も講じていない。
ワクチン接種の間違いを最小限に抑えるため、製造販売業者は医
療従事者に対して、投与に関する教育資料を提供し続け、新しい製
剤が使用可能になった時及び過去の製剤がこれ以上市場で使用さ
れなくなった時にコミュニケーションを実施している。
5. SUMMARY OF SAFETY CONCERNS
Table 10は報告対象期間の初期にBNT162b2の世界的なリスクマネ
ジメント及びファーマコヴィジランス計画で反映された重要なリスク及
び不足情報を要約した総合的なリストである。
重要な特定されたリスク:Anaphylaxis、Myocarditis and Pericarditis
重要な潜在的リスク:Vaccine-Associated Enhanced Disease
(VAED) including Vaccine-Associated Enhanced Respiratory
Disease (VAERD)、Guillain-Barre syndrome
不足情報: Use in Pregnancy and While Breast Feeding、Use in
Immunocompromised Patients、Use in Frail Patients With Coコロナウイルス(SA
Morbidities (e.g. COPD, Diabetes, Chronic Neurological Disease,
136 RS-CoV-2)RN
アメリカ
Cardiovascular disorders, Active tuberculosis)、Use in Patients
Aワクチン
With Autoimmune or Inflammatory Disorders、Interaction With
Other Vaccines、Long-Term Safety Data、Use in Pediatric
Individuals less than 6 Months of Age、Vaccine Effectiveness
6. OVERVIEW OF SAFETY SIGNALS DURING THE REPORTING
INTERVAL
Overview of Signals(Table 11)は報告対象期間中に対処もしくは評
価中であったシグナルである。
Pulmonary Embolism (PE)(Ongoing、N/A)、Post-Menopausal
Haemorrhage (PMH) (Ongoing、N/A)が記載されている。
8. CONCLUSION AND ACTIONS
BNT162b2起源株、BNT162b2 2価(起源株、オミクロン株BA.1)、
BNT162b2 2価(起源株、オミクロン株BA.4/BA.5)及びBNT162b2
(オミクロン株XBB.1.5)の報告期間における利用可能な安全性及び
有効性データに基づくと、BNT162b2のベネフィット・リスクプロファイ
ルは引き続き良好である。
集積安全性データ及びベネフィット・リスク解析の評価に基づき、RSI
(安全性参照情報)の変更や追加のリスク最小化活動は必要とされ
ない。
MAHは、すべての有害事象の報告を含むBNT162b2起源株、
BNT162b2 2価(起源株、オミクロン株BA.1)、BNT162b2 2価(起源
株、オミクロン株BA.4/BA.5)及びBNT162b2 (オミクロン株XBB.1.5)
の安全性を引き続き検討し、安全性データの評価で重要な新たな
情報が得られた場合には、製品文書を改訂する。
その他
注目
欧州PRACは、バルプロ酸による治療を受けている男性患者に対し
て予防措置を採ることを推奨している。この措置は妊娠前3カ月間に
バルプロ酸による治療を受けた男性患者を親とする児に認められた
神経発達障害の潜在的リスクに対応するものである。
医師はバルプロ酸を使用している男性患者に対し、当該情報を提
137 バルプロ酸ナトリウム
欧州連合
供し、男性患者及びパートナーの女性に適切な避妊について検討
する必要があることを伝えるべきである。また、バルプロ酸による治
療が男性患者にとって最も適切な治療法であるのか、定期的に確
認すべきであり、特に子供を持つことを計画している場合には確認
が重要である。
その他
対応中
独BfArMは以下の情報を公表した。
138 バルプロ酸ナトリウム ・欧州PRACがバルプロ酸による治療を受けている男性患者に対し
て予防措置を採ることを推奨している。
その他
対応中
その他
対応中
No. 医薬品名(一般名) 措置概要
措置国
ドイツ
英MHRAは、妊娠前3カ月間にバルプロ酸による治療を受けた男性
139 バルプロ酸ナトリウム 患者を親とする児における神経発達障害の潜在的リスクに関して、 イギリス
研究結果の修正を受領し、分析が実施されていることを公表した。
26