よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
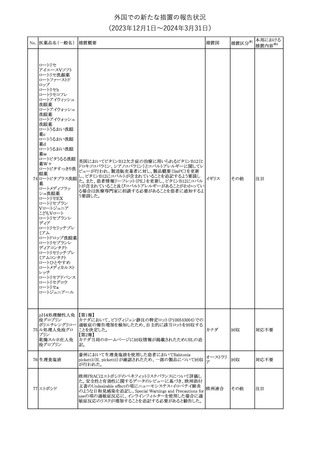
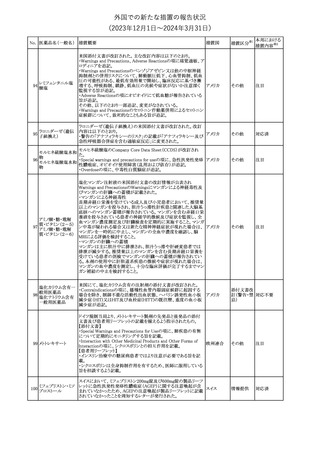
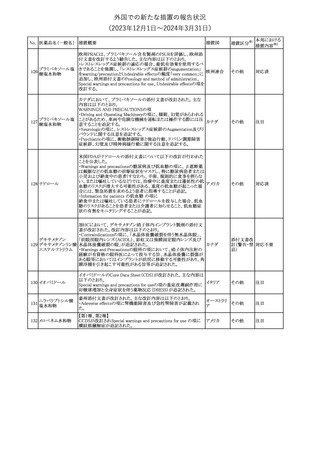
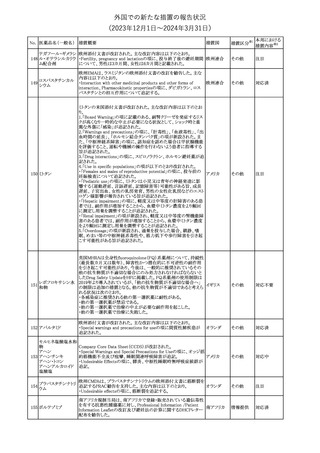
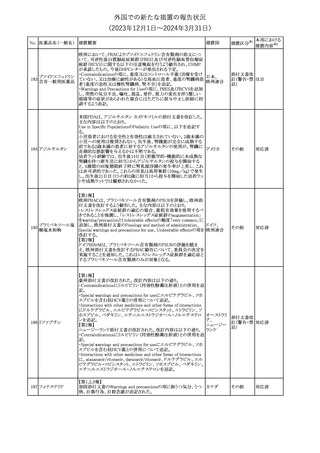
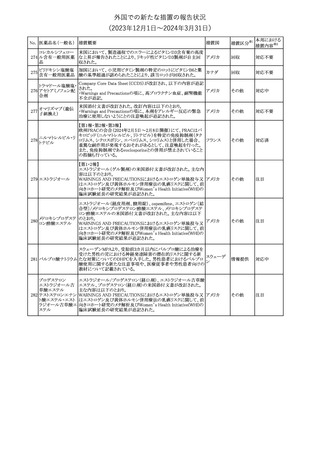
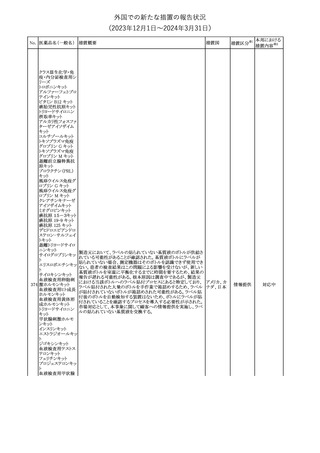
No. 医薬品名(一般名) 措置概要
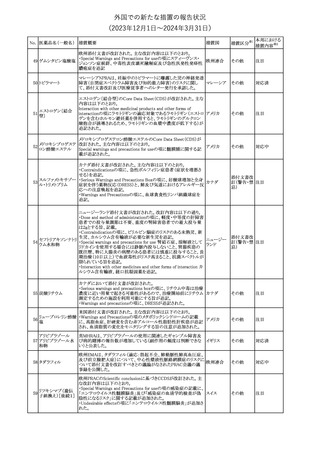
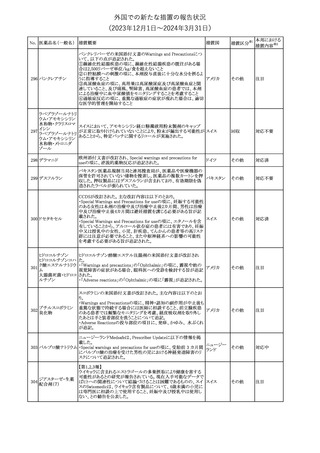
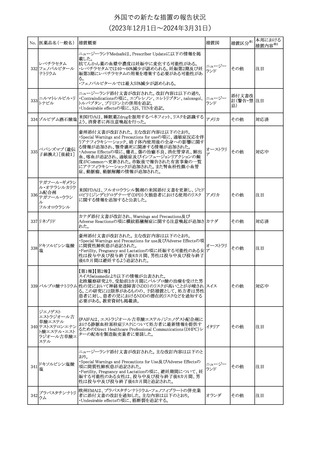
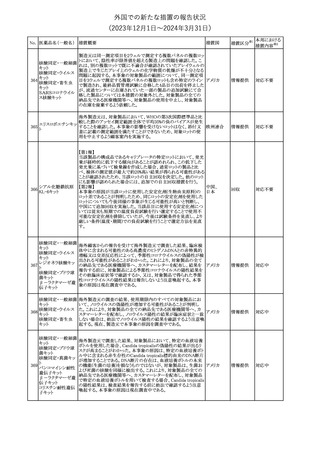
188
アンピロキシカム
ピロキシカム
措置国
欧州において、PRACよりピロキシカム含有局所製剤の添文につい
て以下の内容を改訂するよう勧告され、CMDhが合意したもの。
・Contraindicationsの項、経口剤等と同様に妊娠後期を禁忌とする
オランダ
こと。また、妊娠前期及び妊娠中期では必要な場合のみ使用し、使
用の際には可能な限り投与量及び投与期間を少なくすることを追
記。
措置区分※1
本邦における
措置内容※2
添付文書改
訂(警告・禁 対応不要
忌)
欧州EMAは、テルミサルタン・ヒドロクロロチアジドの添付文書の改訂
を勧告した。主な内容は以下のとおり。
・Effects on ability to drive and use machinesの項を更新し、
ロサルタンカリウム・ Undesirable effectsの項の副作用表と整合させるため、「眠気」の用
189 ヒドロクロロチアジド 語を「失神またはめまい」に置き換える。
欧州連合
配合剤
・PHARMACOLOGICAL PROPERTIESのPreclinical safety dataの
項を更新し、PIとの矛盾に対処するため、「ヒドロクロロチアジドに関
する広範なヒトでの経験は、その使用と新生物の増加との関連を示
すことができなかった。」の記載を削除する。
その他
対応不要
トラマドール塩酸塩・ 米国FDAは、アセトアミノフェン製剤の注意喚起情報で、過量投与
190 アセトアミノフェン配 及び重度の肝損傷を引き起こす可能性があるため、1日の推奨最大 アメリカ
合剤
量を超えないよう注意するため消費者に勧告した。
その他
対応済
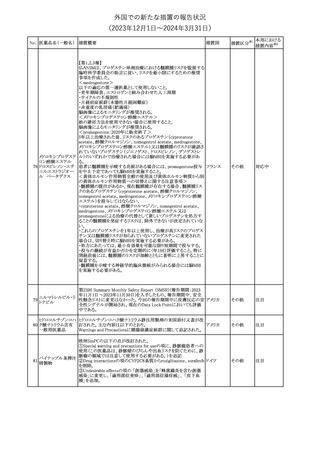
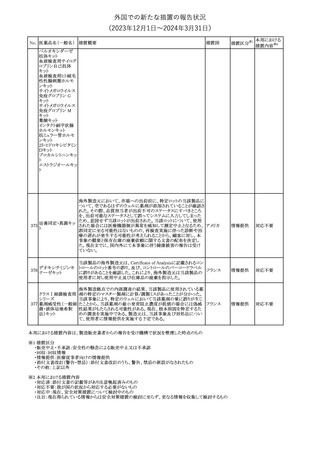
製造元における苦情調査の結果、特定の試薬の液量不足により測
定機器で吸引エラーが発生することが確認された。苦情情報によ
り、特定の試薬において、100回用の試薬に対して約65回分の液量
であった。顧客へ情報提供文書を提供し、速やかに対象ロットの使
用を中止し、在庫分も含め廃棄すること等について通知した。製造 アメリカ、
元によるこれまでの調査の結果、対象ロットの製品の分注日を含む 欧州連合、
B 型肝炎ウイルス表
前後一定期間の製造記録より、分注工程に問題は認められていな カナダ、
情報提供
191
面抗体キット
いことが確認されている。現在、製造元において当該不具合の原因 オーストラリ
調査中である。原因調査の結果に基づき、是正措置が講じられる予 ア
定である。他のロットの製品において、試薬ボトルの液量不足による
吸引エラーの苦情の増加は観察されていないため、現時点におい
て他のロットの製品に当該不良が及ぶものではないと判断し、範囲
は対象ロットに特定された。
対応不要
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
ニボルマブ(遺伝子
・Special Warnings and Precautions for useの項のOther immune組換え)
related adverse reactionsの記載に、ニボルマブ(遺伝子組換え)単 欧州連合
192
イピリムマブ(遺伝子
独投与又はニボルマブ(遺伝子組換え)及びイピリムマブ(遺伝子組
組換え)
換え)の併用投与における脊髄炎が追記された。
その他
対応中
静注アプロチニン製剤に関する科学的結論やPASS最終報告書の
懸念に基づき、PRACは、静注アプロチニン製剤の適応外使用を減
少させ、主なリスク及び使用中に十分な抗凝固療法を確保する方法
について医療従事者を教育することを目的とした、最新の教育プロ
グラムが必要であると判断した。結果として、リスク管理計画を随時
フィブリノゲン加第1 更新することが必要であり、製品情報の更新(SmPCの改訂含む)が
193
欧州連合
3因子(2)
推奨された。静注アプロチニン製剤に関する科学的結論やPASS最
終報告書の懸念に基づき、CMDhは提案された製品情報が変更さ
れることを条件として、ベネフィットリスクバランスは変化しないと考え
た。また、CMDhは、このPASS最終報告書に関係する製品販売承認
は変更されるべきであるという見解に達した。CMDhは、PRACの科
学的結論に同意した。
その他
対応不要
対応不要
194 メロキシカム
米国において、メロキシカム含有注射剤の米国添付文書の
Warnings and Precautionsの項に、関節内投与は承認されておら
アメリカ
ず、動物実験において膝関節内投与により軟骨壊死及び変性がみ
られた旨を追記したもの。
その他
195 ガドテリドール
ガドテリドールの米国添付文書が改訂され、Boxed Warning及び
Warnings and Precautionsに髄腔内投与に関連するリスクが追記さ
れた。
添付文書改
訂(警告・禁 対応済
忌)
33
アメリカ
(2023年12⽉1⽇〜2024年3⽉31⽇)
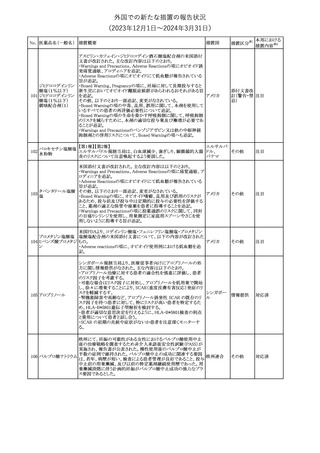
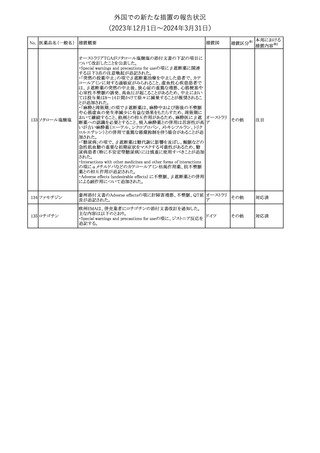
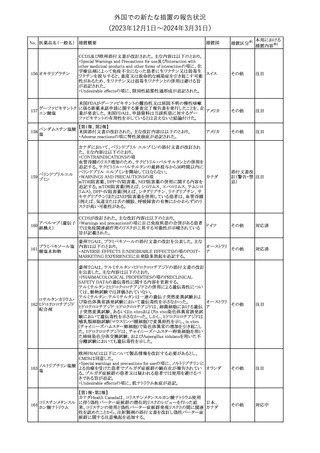
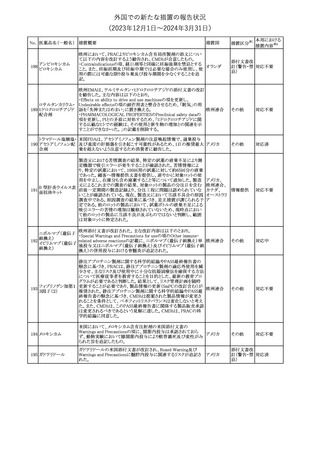
No. 医薬品名(一般名) 措置概要
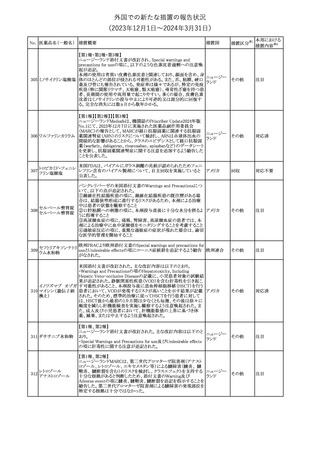
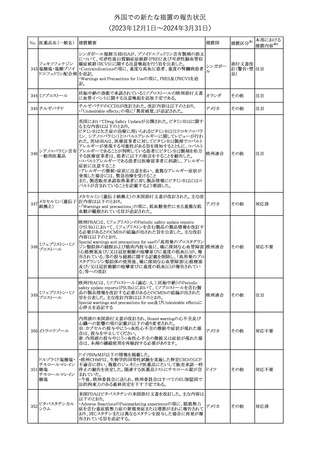
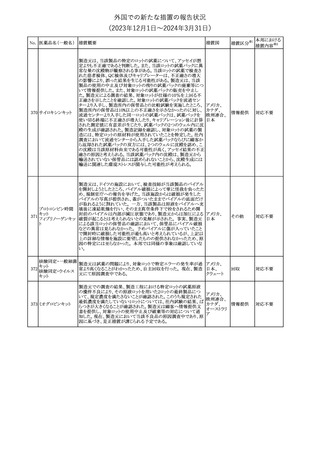
188
アンピロキシカム
ピロキシカム
措置国
欧州において、PRACよりピロキシカム含有局所製剤の添文につい
て以下の内容を改訂するよう勧告され、CMDhが合意したもの。
・Contraindicationsの項、経口剤等と同様に妊娠後期を禁忌とする
オランダ
こと。また、妊娠前期及び妊娠中期では必要な場合のみ使用し、使
用の際には可能な限り投与量及び投与期間を少なくすることを追
記。
措置区分※1
本邦における
措置内容※2
添付文書改
訂(警告・禁 対応不要
忌)
欧州EMAは、テルミサルタン・ヒドロクロロチアジドの添付文書の改訂
を勧告した。主な内容は以下のとおり。
・Effects on ability to drive and use machinesの項を更新し、
ロサルタンカリウム・ Undesirable effectsの項の副作用表と整合させるため、「眠気」の用
189 ヒドロクロロチアジド 語を「失神またはめまい」に置き換える。
欧州連合
配合剤
・PHARMACOLOGICAL PROPERTIESのPreclinical safety dataの
項を更新し、PIとの矛盾に対処するため、「ヒドロクロロチアジドに関
する広範なヒトでの経験は、その使用と新生物の増加との関連を示
すことができなかった。」の記載を削除する。
その他
対応不要
トラマドール塩酸塩・ 米国FDAは、アセトアミノフェン製剤の注意喚起情報で、過量投与
190 アセトアミノフェン配 及び重度の肝損傷を引き起こす可能性があるため、1日の推奨最大 アメリカ
合剤
量を超えないよう注意するため消費者に勧告した。
その他
対応済
製造元における苦情調査の結果、特定の試薬の液量不足により測
定機器で吸引エラーが発生することが確認された。苦情情報によ
り、特定の試薬において、100回用の試薬に対して約65回分の液量
であった。顧客へ情報提供文書を提供し、速やかに対象ロットの使
用を中止し、在庫分も含め廃棄すること等について通知した。製造 アメリカ、
元によるこれまでの調査の結果、対象ロットの製品の分注日を含む 欧州連合、
B 型肝炎ウイルス表
前後一定期間の製造記録より、分注工程に問題は認められていな カナダ、
情報提供
191
面抗体キット
いことが確認されている。現在、製造元において当該不具合の原因 オーストラリ
調査中である。原因調査の結果に基づき、是正措置が講じられる予 ア
定である。他のロットの製品において、試薬ボトルの液量不足による
吸引エラーの苦情の増加は観察されていないため、現時点におい
て他のロットの製品に当該不良が及ぶものではないと判断し、範囲
は対象ロットに特定された。
対応不要
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
ニボルマブ(遺伝子
・Special Warnings and Precautions for useの項のOther immune組換え)
related adverse reactionsの記載に、ニボルマブ(遺伝子組換え)単 欧州連合
192
イピリムマブ(遺伝子
独投与又はニボルマブ(遺伝子組換え)及びイピリムマブ(遺伝子組
組換え)
換え)の併用投与における脊髄炎が追記された。
その他
対応中
静注アプロチニン製剤に関する科学的結論やPASS最終報告書の
懸念に基づき、PRACは、静注アプロチニン製剤の適応外使用を減
少させ、主なリスク及び使用中に十分な抗凝固療法を確保する方法
について医療従事者を教育することを目的とした、最新の教育プロ
グラムが必要であると判断した。結果として、リスク管理計画を随時
フィブリノゲン加第1 更新することが必要であり、製品情報の更新(SmPCの改訂含む)が
193
欧州連合
3因子(2)
推奨された。静注アプロチニン製剤に関する科学的結論やPASS最
終報告書の懸念に基づき、CMDhは提案された製品情報が変更さ
れることを条件として、ベネフィットリスクバランスは変化しないと考え
た。また、CMDhは、このPASS最終報告書に関係する製品販売承認
は変更されるべきであるという見解に達した。CMDhは、PRACの科
学的結論に同意した。
その他
対応不要
対応不要
194 メロキシカム
米国において、メロキシカム含有注射剤の米国添付文書の
Warnings and Precautionsの項に、関節内投与は承認されておら
アメリカ
ず、動物実験において膝関節内投与により軟骨壊死及び変性がみ
られた旨を追記したもの。
その他
195 ガドテリドール
ガドテリドールの米国添付文書が改訂され、Boxed Warning及び
Warnings and Precautionsに髄腔内投与に関連するリスクが追記さ
れた。
添付文書改
訂(警告・禁 対応済
忌)
33
アメリカ