よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (48 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
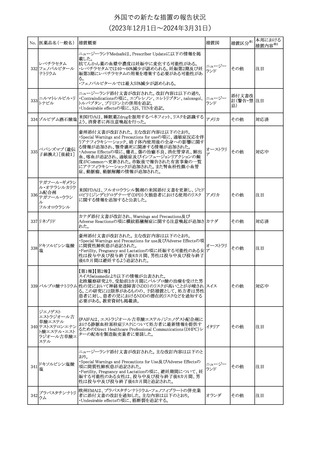
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
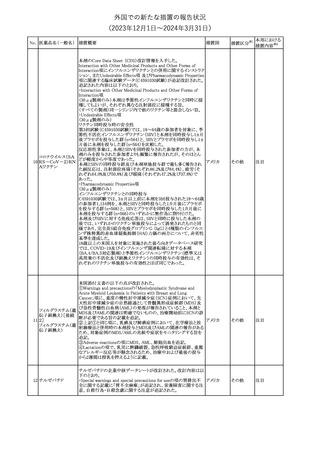
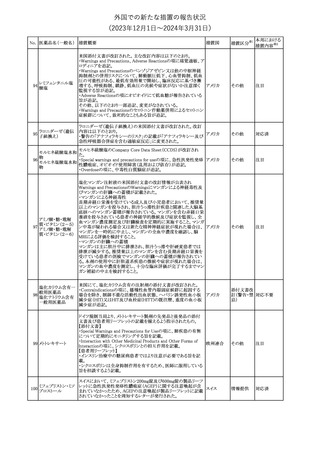
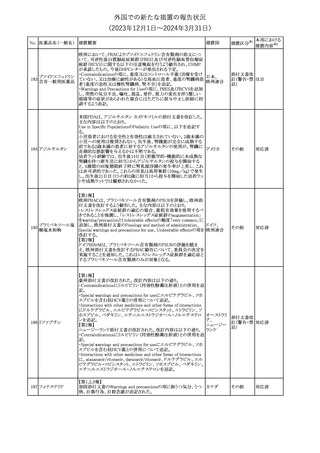
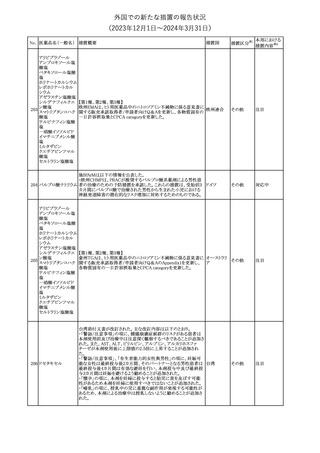
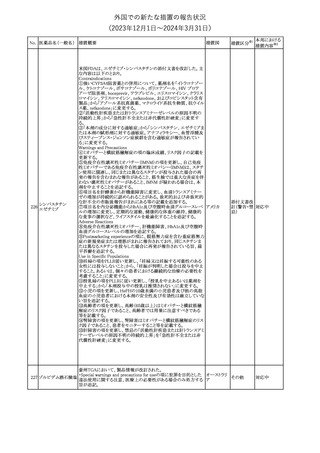
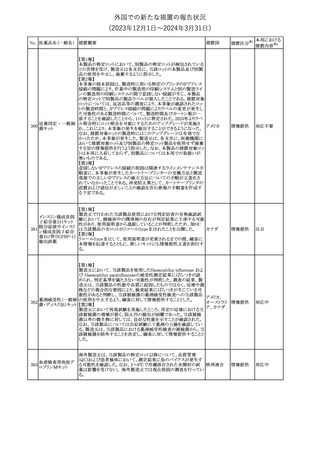
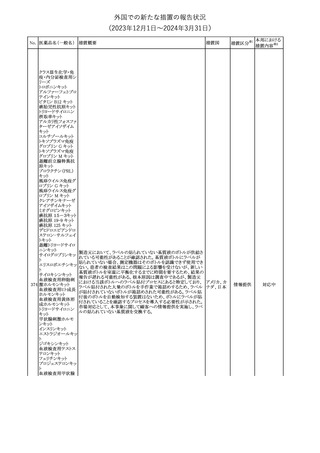
No. 医薬品名(一般名) 措置概要
措置国
欧州EMAはクロピドグレル含有製剤の添付文書のTherapeutic
indication、Posology and method of administration、Special
warnings and precautions for useおよびPharmacodynamic
propertiesの項を更新し、経皮的冠動脈インターベンション(PCI)を
受けるST上昇急性心筋梗塞(STEMI)患者において、本剤にアセチ
欧州連合
ルサリチル酸を併用することの注意を追加した。また、Special
warnings and precautions for useおよびUndesirable effectsの項を更
新し、「出血および気分障害」に関する既存の注意に、3剤併用抗血
小板療法に関する記述(クロピドグレル+アスピリン+ジピリダモール)
を追加した。
措置区分※1
本邦における
措置内容※2
その他
対応済
287
クロピドグレル硫酸
塩
288
乾燥BCG膀胱内用 梱包段階での調整不良による密封性に関する欠陥により、特定ロッ
フランス
(日本株)
トの製剤がリコールされた。
回収
対応不要
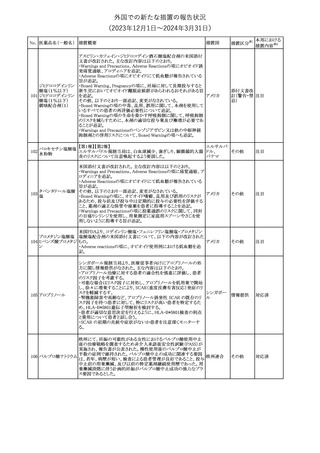
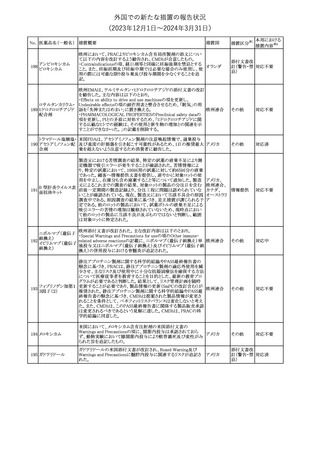
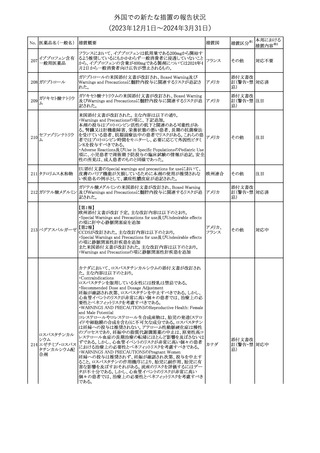
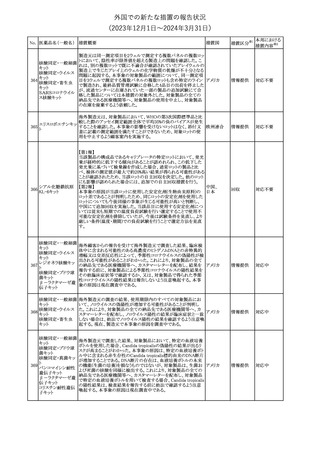
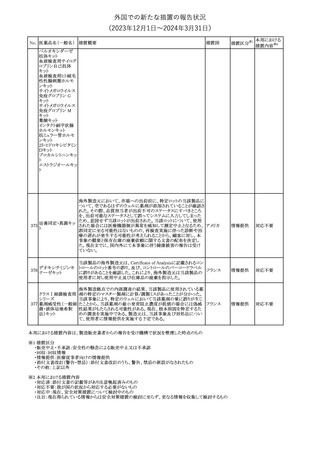
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
・Special Warnings and Precautions for useの項に、自己免疫疾患の
アテゾリズマブ(遺伝 既往がある患者では、免疫チェックポイント阻害剤治療後の免疫介
289
欧州連合
子組換え)
在性副作用のリスクが既往がない患者と比較して上昇する可能性が
あり、基礎疾患である自己免疫疾患の再燃が高頻度に認められた
が、大部分は軽度で管理可能である旨が記載された。
その他
対応済
メカセルミン(遺伝子組換え)の欧州製品概要が改訂された。主な改
訂内容は以下のとおり。
・「Posology and method of administration」の項に、治療開始時及び
適切な用量が確立されるまで食前の血糖モニタリングが推奨される
旨、低血糖の症状が頻繁に発生する場合、低血糖症状の場合でも
メカセルミン(遺伝子 血糖モニタリングを継続することが推奨される旨が追記され、脂肪肥
290
欧州連合
組換え)
大症の発現を防ぐため投与部位を都度変更すべき旨が追記され
た。
・「Fertility, pregnancy and lactation」の項の妊娠中の投与につい
て、「明確に必要でない限り妊娠中に使用すべきでない」が「妊娠中
に使用すべきでない」へ変更された。
・「Undesirable effects」の項に臨床試験の患者数が追記された。
その他
注目
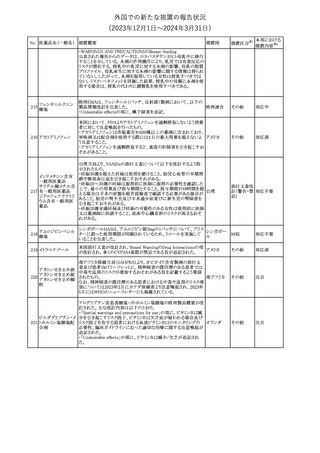
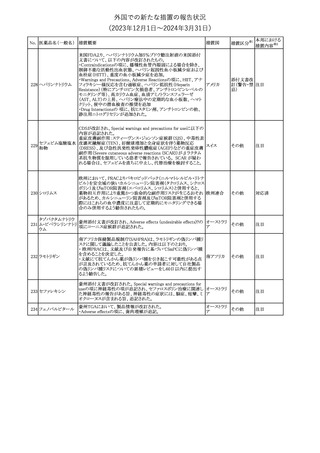
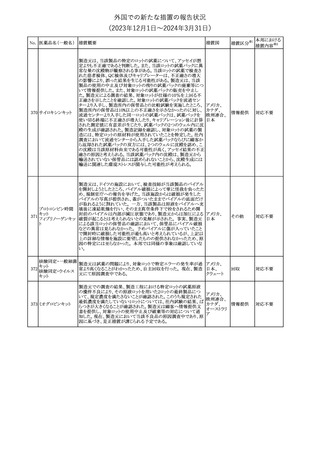
291 セルトラリン塩酸塩
欧州添付文書が改訂された。内容は以下のとおり。
・Special warnings and precautions for use及びInteraction with
other medicinal products and other forms of interactionの項に、ブ 欧州連合
プレノルフィンの併用にて、セロトニン症候群又は悪性症候群のリス
クが増加する旨が追記。
その他
注目
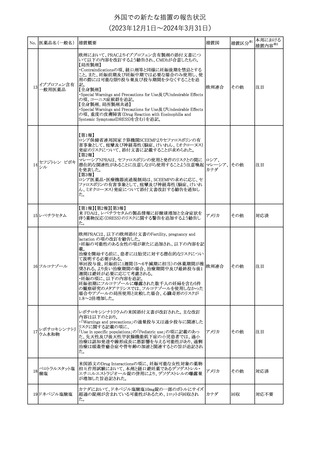
292 シンバスタチン
ニュージーランドMedsafeは、シンバスタチンの添付文書を改訂し
た。主な内容は以下のとおり。
・Special warnings and precautions for use、Undesirable effetsの項 ニュージー
その他
に重症筋無力症、眼筋無力症を追記する。
ランド
・Interactions with other medicines and other forms of interactionの
項に、チカグレロルとの相互作用を追記する。
注目
【第1報、第2報、第3報】
プラミペキソールの欧州添付文書が改訂された。主な内容は以下の
とおり。
・Posology and method of administrationの項に、レストレスレッグス
プラミペキソール塩 症候群の適応の場合、最低有効量を使用するべきであることを追記
293
欧州連合
酸塩水和物
する。
・Special warnings and precautions for useのレストレスレッグス症候
群のaugmentationに関する注意を改訂し、Adverse Reactionsの項
のレストレスレッグス症候群に適応の場合に、レストレスレッグス症候
群のaugmentationを追記する。
その他
ニュージーランド添付文書が改訂された。主な改訂内容は以下のと
テガフール・ギメラシ
おり。
ル・オテラシルカリウ
・Fertility, Pregnancy and Lactationの項において、妊娠可能な年齢 ニュージー
294 ム配合剤
その他
の女性は妊娠を避け、本剤投与中及び最終投与後少なくとも6カ月 ランド
テガフール・ウラシ
間は避妊すること、男性は本剤の投与中及び投与中止後少なくとも
ル
3カ月間は避妊することが追記された。
295 タダラフィル
加HCは、タダラフィル(効能:勃起不全)の偽造品を押収したことを
公表した。
48
カナダ
回収
対応済
注目
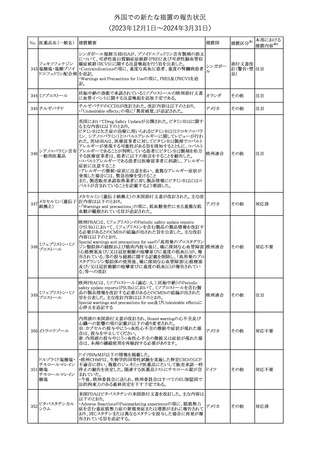
対応不要
(2023年12⽉1⽇〜2024年3⽉31⽇)
No. 医薬品名(一般名) 措置概要
措置国
欧州EMAはクロピドグレル含有製剤の添付文書のTherapeutic
indication、Posology and method of administration、Special
warnings and precautions for useおよびPharmacodynamic
propertiesの項を更新し、経皮的冠動脈インターベンション(PCI)を
受けるST上昇急性心筋梗塞(STEMI)患者において、本剤にアセチ
欧州連合
ルサリチル酸を併用することの注意を追加した。また、Special
warnings and precautions for useおよびUndesirable effectsの項を更
新し、「出血および気分障害」に関する既存の注意に、3剤併用抗血
小板療法に関する記述(クロピドグレル+アスピリン+ジピリダモール)
を追加した。
措置区分※1
本邦における
措置内容※2
その他
対応済
287
クロピドグレル硫酸
塩
288
乾燥BCG膀胱内用 梱包段階での調整不良による密封性に関する欠陥により、特定ロッ
フランス
(日本株)
トの製剤がリコールされた。
回収
対応不要
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
・Special Warnings and Precautions for useの項に、自己免疫疾患の
アテゾリズマブ(遺伝 既往がある患者では、免疫チェックポイント阻害剤治療後の免疫介
289
欧州連合
子組換え)
在性副作用のリスクが既往がない患者と比較して上昇する可能性が
あり、基礎疾患である自己免疫疾患の再燃が高頻度に認められた
が、大部分は軽度で管理可能である旨が記載された。
その他
対応済
メカセルミン(遺伝子組換え)の欧州製品概要が改訂された。主な改
訂内容は以下のとおり。
・「Posology and method of administration」の項に、治療開始時及び
適切な用量が確立されるまで食前の血糖モニタリングが推奨される
旨、低血糖の症状が頻繁に発生する場合、低血糖症状の場合でも
メカセルミン(遺伝子 血糖モニタリングを継続することが推奨される旨が追記され、脂肪肥
290
欧州連合
組換え)
大症の発現を防ぐため投与部位を都度変更すべき旨が追記され
た。
・「Fertility, pregnancy and lactation」の項の妊娠中の投与につい
て、「明確に必要でない限り妊娠中に使用すべきでない」が「妊娠中
に使用すべきでない」へ変更された。
・「Undesirable effects」の項に臨床試験の患者数が追記された。
その他
注目
291 セルトラリン塩酸塩
欧州添付文書が改訂された。内容は以下のとおり。
・Special warnings and precautions for use及びInteraction with
other medicinal products and other forms of interactionの項に、ブ 欧州連合
プレノルフィンの併用にて、セロトニン症候群又は悪性症候群のリス
クが増加する旨が追記。
その他
注目
292 シンバスタチン
ニュージーランドMedsafeは、シンバスタチンの添付文書を改訂し
た。主な内容は以下のとおり。
・Special warnings and precautions for use、Undesirable effetsの項 ニュージー
その他
に重症筋無力症、眼筋無力症を追記する。
ランド
・Interactions with other medicines and other forms of interactionの
項に、チカグレロルとの相互作用を追記する。
注目
【第1報、第2報、第3報】
プラミペキソールの欧州添付文書が改訂された。主な内容は以下の
とおり。
・Posology and method of administrationの項に、レストレスレッグス
プラミペキソール塩 症候群の適応の場合、最低有効量を使用するべきであることを追記
293
欧州連合
酸塩水和物
する。
・Special warnings and precautions for useのレストレスレッグス症候
群のaugmentationに関する注意を改訂し、Adverse Reactionsの項
のレストレスレッグス症候群に適応の場合に、レストレスレッグス症候
群のaugmentationを追記する。
その他
ニュージーランド添付文書が改訂された。主な改訂内容は以下のと
テガフール・ギメラシ
おり。
ル・オテラシルカリウ
・Fertility, Pregnancy and Lactationの項において、妊娠可能な年齢 ニュージー
294 ム配合剤
その他
の女性は妊娠を避け、本剤投与中及び最終投与後少なくとも6カ月 ランド
テガフール・ウラシ
間は避妊すること、男性は本剤の投与中及び投与中止後少なくとも
ル
3カ月間は避妊することが追記された。
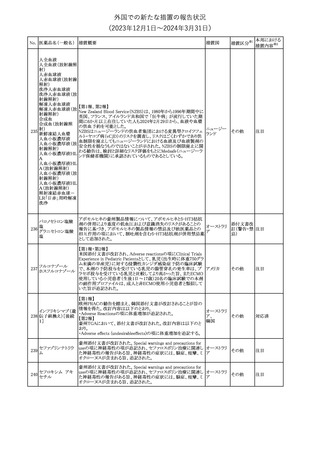
295 タダラフィル
加HCは、タダラフィル(効能:勃起不全)の偽造品を押収したことを
公表した。
48
カナダ
回収
対応済
注目
対応不要