よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
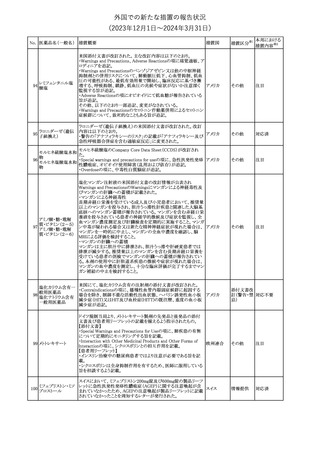
(2023年12⽉1⽇〜2024年3⽉31⽇)
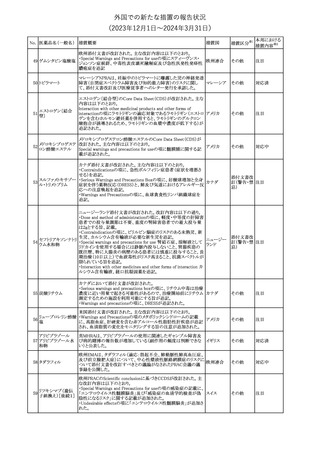
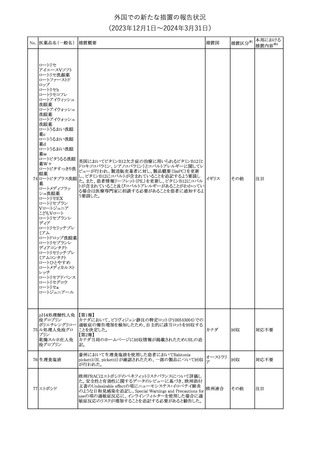
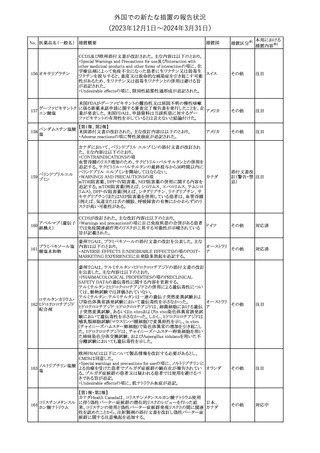
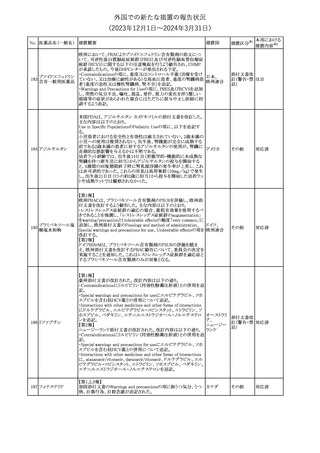
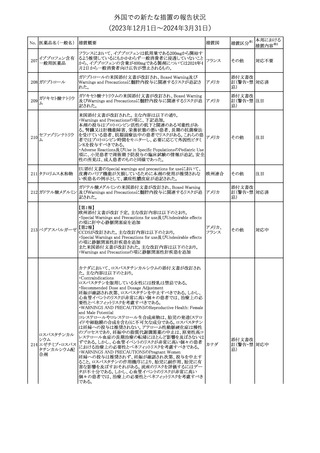
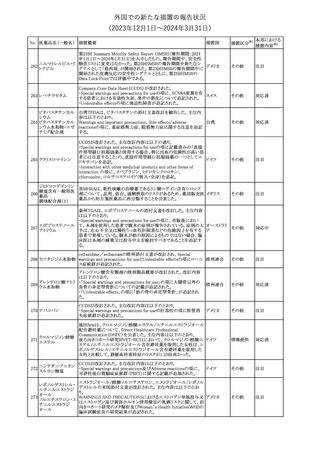
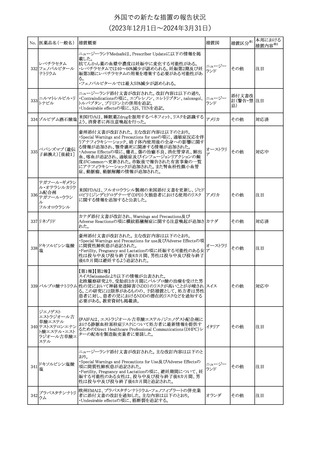
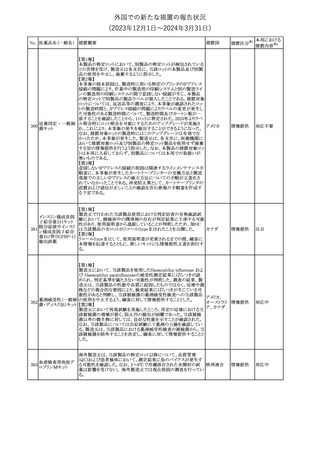
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
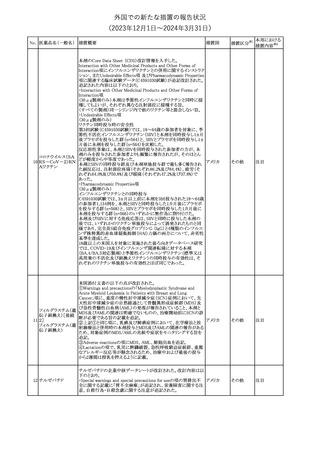
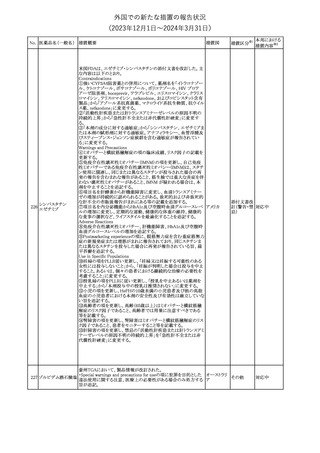
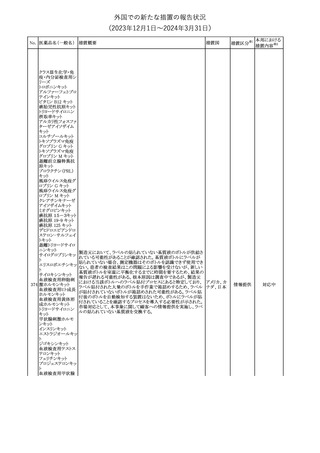
241 アロプリノール
【第1、2、3報】
アロプリノールの豪州製品情報が改訂された。改訂内容は以下のと
おり。
1.「Special warnings and precautions for use」の項に、痛風の急性発
作が治まるまでアロプリノールを開始しないこと、開始後、少なくとも
1ヶ月間は抗炎症薬又はコルヒチンで予防すること、アロプリノール オーストラリ
その他
開始後の急性発作に抗炎症剤を使用している間、同じ用量で継続 ア
する必要がある旨が追記された。
2.「Interactions with other medicines and other forms of
interactions」の項の、メルカプトプリン及びアザチオプリンとの相互
作用、クマリン系抗凝固薬との相互作用について更新された。
3.「Adverse effects」の項に、SJS/TENについて追記された。
対応済
242 メトトレキサート
【第1、2、3報】
豪州において、TGAよりメトトレキサート製剤の添付文書について以
下の内容が改訂された。
オーストラリ
・Special Warnings and Precautions for Useの項に、光線過敏症に
その他
ア
関する注意喚起を追記。
・Adverse Effectsの項に浮腫、末梢性浮腫、肺水腫、脳浮腫を追
記。
注目
243 セファクロル
【第1報・第2報】
豪州添付文書が改訂された。Special warnings and precautions for
useの項に神経毒性の項が追記され、セファロスポリン治療に関連し
オーストラリ
た神経毒性の報告がある旨、神経毒性の症状には、脳症、痙攣、ミ
その他
ア
オクローヌスが含まれる旨、追記された。
【第3報】
企業見解が追記されたもの。
注目
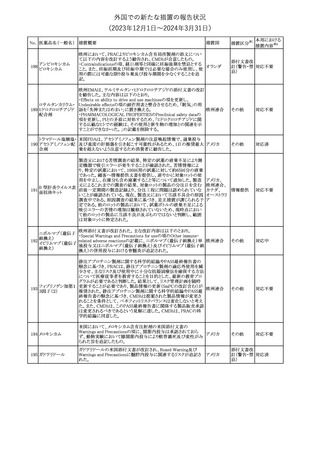
独BfArMは、欧州CHMPが承認した予防措置に沿って、受胎前の3
カ月間にバルプロ酸単独療法による治療を受けた父親を持つ小児
244 バルプロ酸ナトリウム
ドイツ
(0~11歳)の神経発達障害のリスク増加の可能性が示唆されたこと
に関して情報を提供している。
その他
対応中
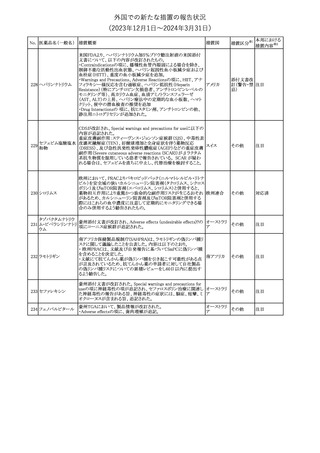
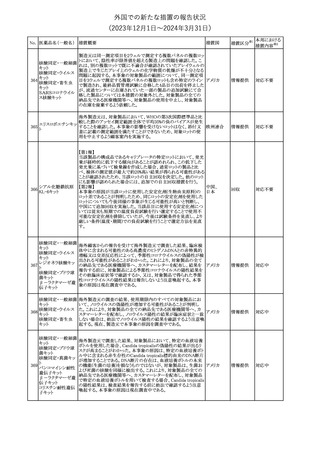
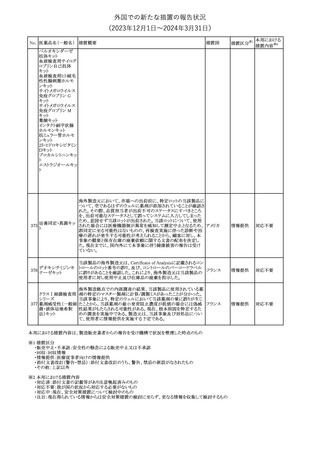
エストロゲン〔結合
型〕
【第1報】
エストロゲン〔結合型〕の米国添付文書が改訂された。主な内容は以
下のとおり。
WARNINGS AND PRECAUTIONSにおけるエストロゲン単独投与又
はエストロゲン及び黄体ホルモン併用療法の乳癌リスクに関して、前
向きコホート研究のメタ解析及びWomen’s Health Initiative(WHI)の
臨床試験延長の研究結果が追記された。
アメリカ
【第2報】
合成エストロゲン〔結合型〕の米国添付文書が改訂された。主な内容
は以下のとおり。
WARNINGS AND PRECAUTIONSにおけるエストロゲン単独投与又
はエストロゲン及び黄体ホルモン併用療法の乳癌リスクに関して、前
向きコホート研究のメタ解析及びWomen’s Health Initiative(WHI)の
臨床試験延長の研究結果が追記された。
その他
注目
246 バルプロ酸ナトリウム
欧州EMAは、父親のバルプロ酸曝露と神経発達障害(NDD)リスク
に関して、非介入承認後安全性試験(PASS)のassessment report及
欧州連合
びCMDhの科学的結論と変更の根拠・製品情報の改訂についての
情報を公表した。
その他
対応中
欧州においてPRACよりジクロフェナク製剤について以下の内容が
勧告されたもの。
・ジクロフェナクの全身製剤について、妊娠20週以降では腎機能障
ジクロフェナクナトリ
害、羊水過少症及び新生児の腎機能障害がおこるおそれがある旨 欧州連合
247
ウム
を警告すること。
・ジクロフェナクの筋注製剤では、Adverse Reactionsの項に薬剤性
塞栓性皮膚症(ニコラウ症候群)を追記すること。
その他
対応不要
欧州PRACは、ドネペジルのPSURを評価し、欧州添付文書を改訂
するよう勧告した。主な内容は以下のとおり。
・Undesirable effectsの項に、リビドー亢進、性欲過剰、側反弓(ピサ
欧州連合
症候群)を追加する。
・睡眠に関連した望ましくない影響が生じた場合の服用タイミングに
関する情報を修正する。
その他
注目
米国添付文書が改訂された。
・Warnings and Precautionsの項に、網膜血管炎が追記。
その他
注目
245
248 ドネペジル塩酸塩
249
ラニビズマブ(遺伝
子組換え)
43
アメリカ
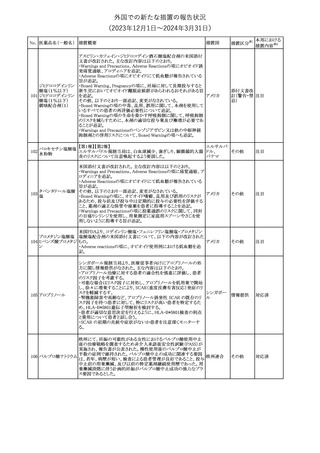
(2023年12⽉1⽇〜2024年3⽉31⽇)
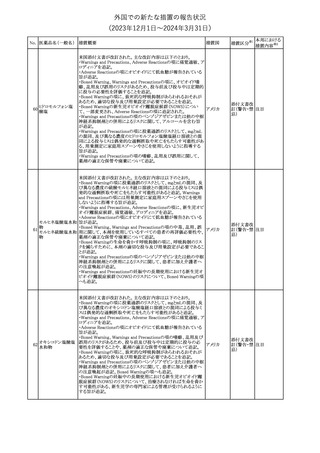
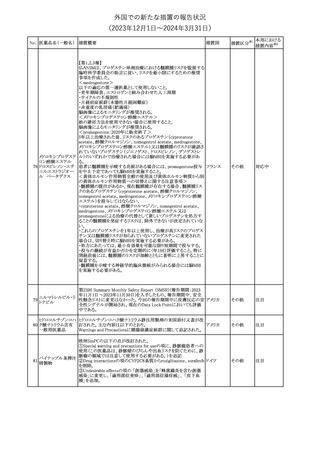
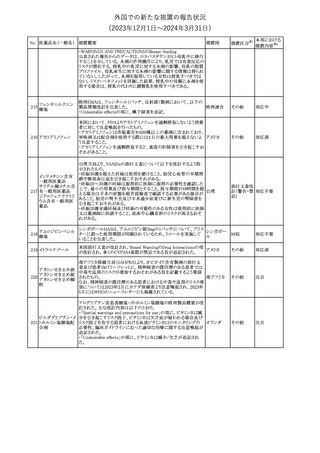
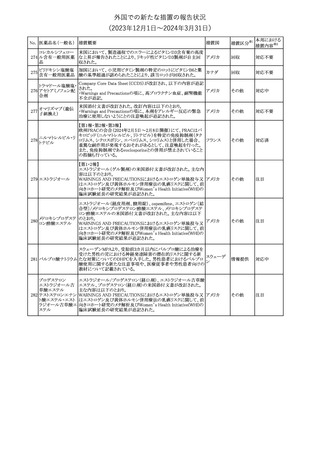
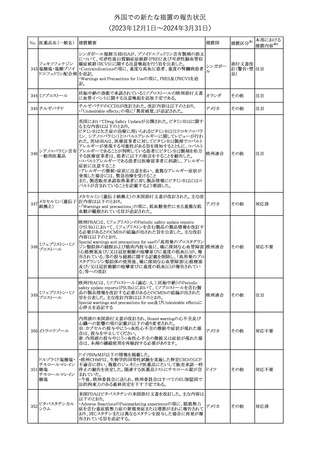
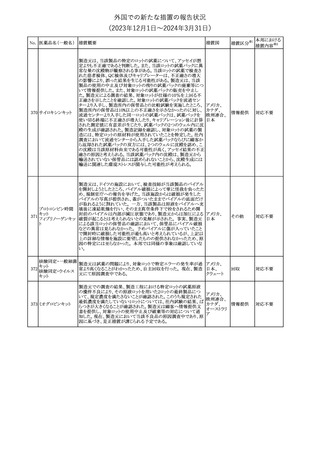
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
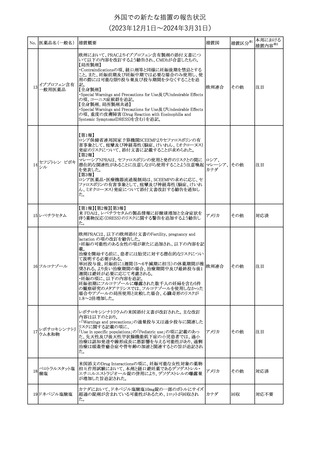
241 アロプリノール
【第1、2、3報】
アロプリノールの豪州製品情報が改訂された。改訂内容は以下のと
おり。
1.「Special warnings and precautions for use」の項に、痛風の急性発
作が治まるまでアロプリノールを開始しないこと、開始後、少なくとも
1ヶ月間は抗炎症薬又はコルヒチンで予防すること、アロプリノール オーストラリ
その他
開始後の急性発作に抗炎症剤を使用している間、同じ用量で継続 ア
する必要がある旨が追記された。
2.「Interactions with other medicines and other forms of
interactions」の項の、メルカプトプリン及びアザチオプリンとの相互
作用、クマリン系抗凝固薬との相互作用について更新された。
3.「Adverse effects」の項に、SJS/TENについて追記された。
対応済
242 メトトレキサート
【第1、2、3報】
豪州において、TGAよりメトトレキサート製剤の添付文書について以
下の内容が改訂された。
オーストラリ
・Special Warnings and Precautions for Useの項に、光線過敏症に
その他
ア
関する注意喚起を追記。
・Adverse Effectsの項に浮腫、末梢性浮腫、肺水腫、脳浮腫を追
記。
注目
243 セファクロル
【第1報・第2報】
豪州添付文書が改訂された。Special warnings and precautions for
useの項に神経毒性の項が追記され、セファロスポリン治療に関連し
オーストラリ
た神経毒性の報告がある旨、神経毒性の症状には、脳症、痙攣、ミ
その他
ア
オクローヌスが含まれる旨、追記された。
【第3報】
企業見解が追記されたもの。
注目
独BfArMは、欧州CHMPが承認した予防措置に沿って、受胎前の3
カ月間にバルプロ酸単独療法による治療を受けた父親を持つ小児
244 バルプロ酸ナトリウム
ドイツ
(0~11歳)の神経発達障害のリスク増加の可能性が示唆されたこと
に関して情報を提供している。
その他
対応中
エストロゲン〔結合
型〕
【第1報】
エストロゲン〔結合型〕の米国添付文書が改訂された。主な内容は以
下のとおり。
WARNINGS AND PRECAUTIONSにおけるエストロゲン単独投与又
はエストロゲン及び黄体ホルモン併用療法の乳癌リスクに関して、前
向きコホート研究のメタ解析及びWomen’s Health Initiative(WHI)の
臨床試験延長の研究結果が追記された。
アメリカ
【第2報】
合成エストロゲン〔結合型〕の米国添付文書が改訂された。主な内容
は以下のとおり。
WARNINGS AND PRECAUTIONSにおけるエストロゲン単独投与又
はエストロゲン及び黄体ホルモン併用療法の乳癌リスクに関して、前
向きコホート研究のメタ解析及びWomen’s Health Initiative(WHI)の
臨床試験延長の研究結果が追記された。
その他
注目
246 バルプロ酸ナトリウム
欧州EMAは、父親のバルプロ酸曝露と神経発達障害(NDD)リスク
に関して、非介入承認後安全性試験(PASS)のassessment report及
欧州連合
びCMDhの科学的結論と変更の根拠・製品情報の改訂についての
情報を公表した。
その他
対応中
欧州においてPRACよりジクロフェナク製剤について以下の内容が
勧告されたもの。
・ジクロフェナクの全身製剤について、妊娠20週以降では腎機能障
ジクロフェナクナトリ
害、羊水過少症及び新生児の腎機能障害がおこるおそれがある旨 欧州連合
247
ウム
を警告すること。
・ジクロフェナクの筋注製剤では、Adverse Reactionsの項に薬剤性
塞栓性皮膚症(ニコラウ症候群)を追記すること。
その他
対応不要
欧州PRACは、ドネペジルのPSURを評価し、欧州添付文書を改訂
するよう勧告した。主な内容は以下のとおり。
・Undesirable effectsの項に、リビドー亢進、性欲過剰、側反弓(ピサ
欧州連合
症候群)を追加する。
・睡眠に関連した望ましくない影響が生じた場合の服用タイミングに
関する情報を修正する。
その他
注目
米国添付文書が改訂された。
・Warnings and Precautionsの項に、網膜血管炎が追記。
その他
注目
245
248 ドネペジル塩酸塩
249
ラニビズマブ(遺伝
子組換え)
43
アメリカ