よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
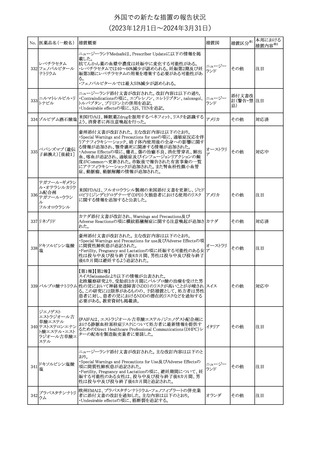
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
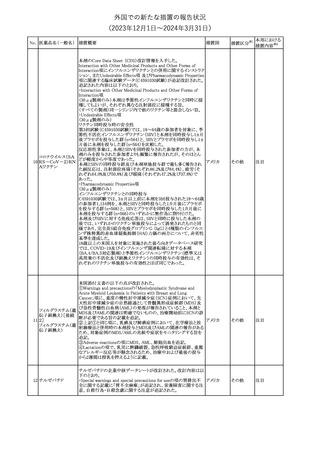
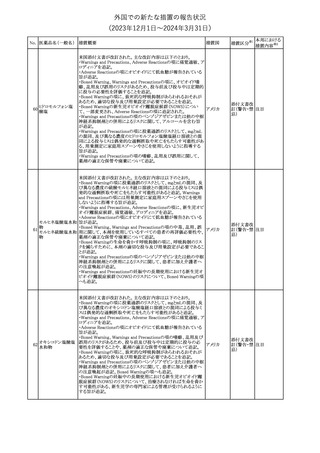
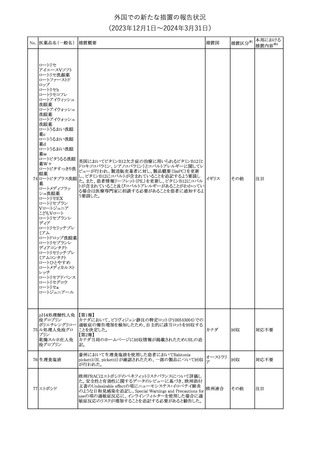
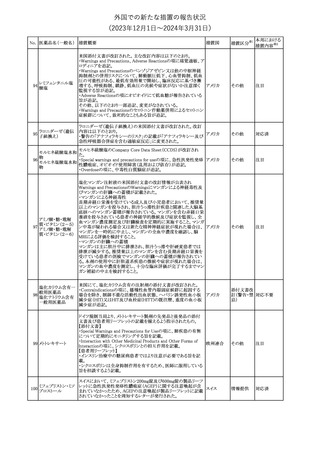
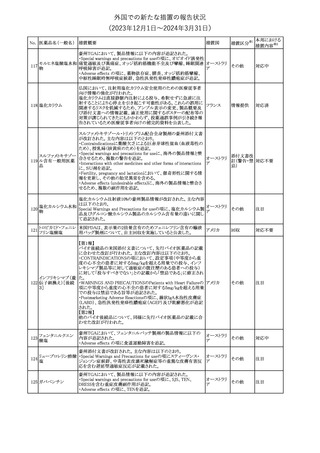
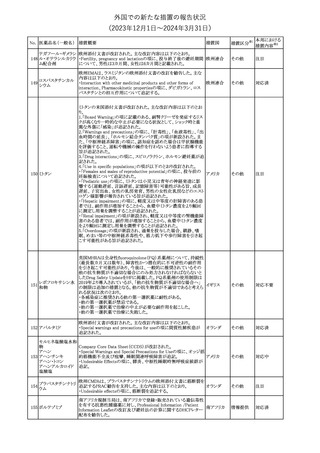
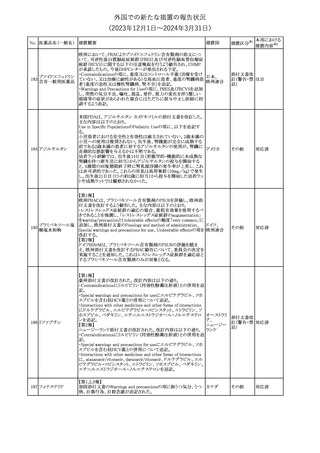
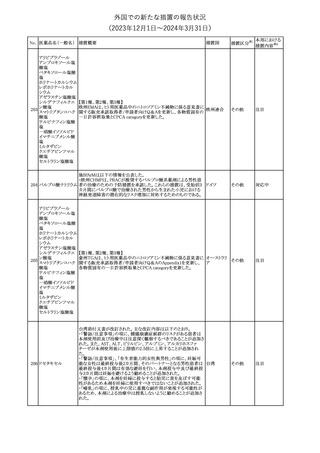
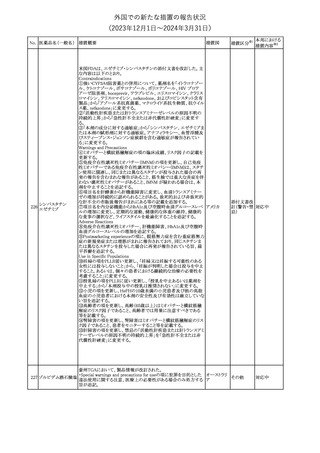
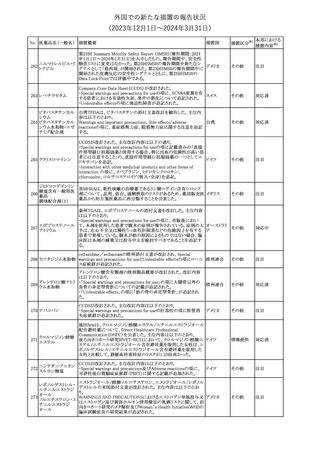
No. 医薬品名(一般名) 措置概要
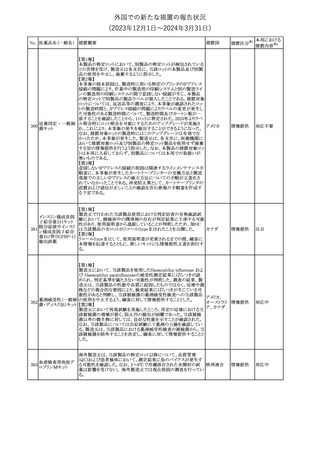
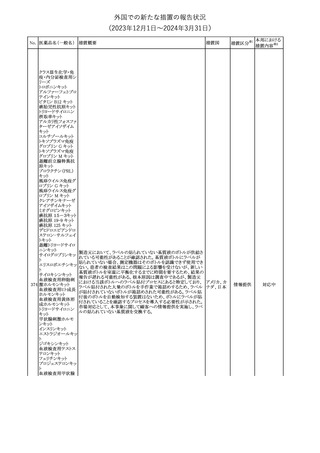
175
措置国
ニュージーランドにおいて製造販売企業より医療従事者向けのレ
ニルマトレルビル・リ
ターが出されたもの。併用禁忌の医薬品にエプレレノン、エレトリプ
トナビル
タン、naloxegol、トルバプタン、プリミドンが追記された。
措置区分※1
ニュージー
その他
ランド
本邦における
措置内容※2
注目
ピタバスタチンカル
シウム
176 ピタバスタチンカル
シウム水和物・エゼ
チミブ配合剤
米国FDAは、ピタバスタチンカルシウムの添付文書の改訂を勧告し
た。主な内容は以下のとおり。
・Adverse ReactionsのPostmarketing Experienceの項に、眼筋無力
アメリカ
症を含む重症筋無力症に関する内容を追記する。
・Adverse ReactionsのPostmarketing Experienceの項の認知障害に
関する情報を精神障害の項から神経系障害の項に移動する。
その他
注目
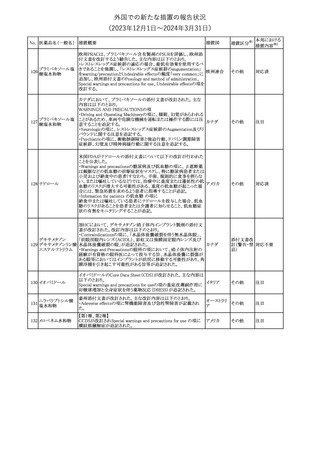
177 アキシチニブ
南アフリカ規制当局は、南アフリカで登録・販売されている遺伝毒性
を有する抗悪性腫瘍薬に対し、Professional Information /Patient
南アフリカ
Information Leafletの改訂及び避妊法の計算に関するDHCPレター
配布を勧告した。
情報提供
対応済
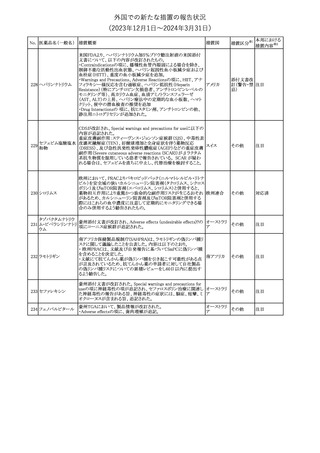
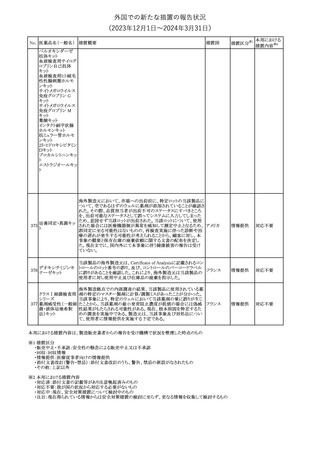
米国FDAは、デノスマブ(遺伝子組換え)(骨粗鬆症の効能・効果を
有する製剤)について、Drug Safety Communicationを発出し、FDA
がレビューを実施した結果、進行性慢性腎臓病 (CKD)患者、特に
CKDに伴う骨ミネラル代謝異常(CKD-MBD)患者において、本剤が
重度の低カルシウム血症、重度の血中カルシウム濃度低下のリスク
を高めると結論付けた旨を公表した。
また、本結果に基づき米国添付文書が改訂された。主な改訂内容
は以下のとおり。
・Boxed warningの項に「進行性腎臓病患者における重度の低カル
シウム血症」が追加され、eGFR<30 mL/min/1.73 m2の患者では低
デノスマブ(遺伝子 カルシウム血症のリスクが高くなる旨、特にCKD-MBDがあるとリスク
178
アメリカ
組換え)
が高くなる旨、進行性腎臓病患者においては投与開始前にCKDMBDの有無を評価すること等が追記された。
・Warnings and precautionsの項に「重度の低カルシウム血症とミネラ
ル代謝の変化」が追加され、本剤開始前に低カルシウム血症の治
療を行うこと、低カルシウム血症の素因のある患者では血清カルシウ
ム及び電解質のモニタリングを行うこと、進行性慢性腎臓病患者で
は特に低カルシウム血症のリスクが高いこと並びに定期的なモニタリ
ング及びカルシウムと活性型ビタミンDの補給が必要である旨等が
追記された。
・Use in specific populationsの「Renal impairment」の項に、上記に
関連した記載が追記された。
添付文書改
訂(警告・禁 注目
忌)
提携会社よりフェンタニルクエン酸塩(舌下錠)のEU RMPを当局に
提出したとの情報を入手した。変更点の概要は以下のとおり。
・偶発的曝露をimportant potential risksからimportant identified
オランダ
risksへ再分類すること
・リスク最小化措置に過量投与の懸念に関しPackage warning(外箱
への警告追記)を追加すること
その他
対応済
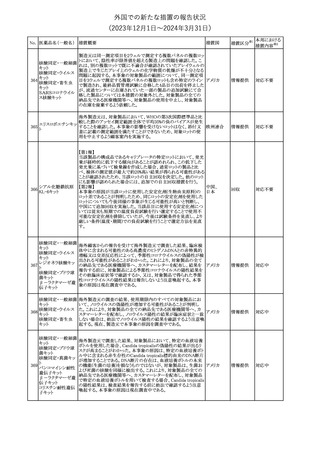
CCDSが改訂された。主な改訂内容は以下のとおり。
・Special Warnings and Precautions for useの項に、重篤な皮膚有害
反応(Severe cutaneous adverse reactions)が記載された。
180 ゲムシタビン塩酸塩 ・Undesirable effectsの項の表の「skin reactions」が「severe skin
アメリカ
reactions」に変更された。該当の表にはスティーブンス・ジョンソン症
候群、中毒性表皮壊死融解症、急性汎発性発疹性膿疱症、落屑及
び水疱性皮膚発疹の記載がある。
その他
注目
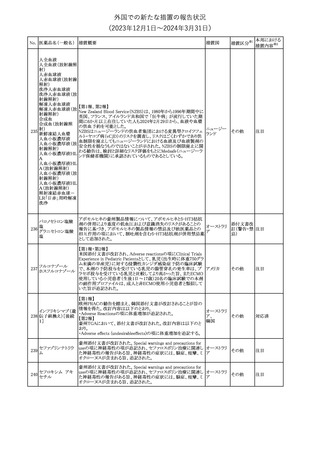
欧州CMDhは、非介入的な承認後安全性試験(PASS)の結果を検
クロルマジノン酢酸
討した結果、クロルマジノン酢酸エステル、エチニルエストラジオー
エステル
ル含有医薬品の添付文書改訂及び販売承認条件の変更(RMPの
181 ノルエチステロン・エ
欧州連合
更新)を勧告した。添付文書改訂の主な内容は以下のとおり。
チニルエストラジ
Special warning and precautions for useの静脈血栓塞栓症に関する
オール
記載の改訂
その他
対応済
回収
対応不要
179
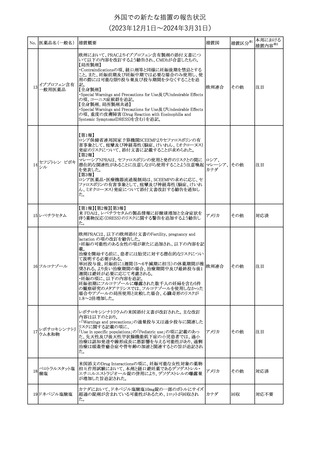
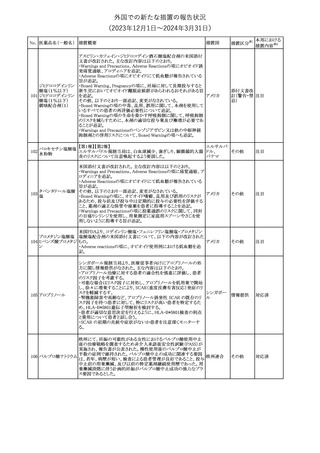
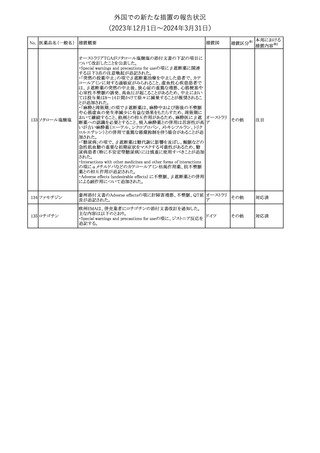
182
フェンタニルクエン
酸塩
ホスアプレピタントメ 米国において、ホスアプレピタントの一部ロットについて、無菌性が
グルミン
担保されていないことから回収が行われた。
31
アメリカ
(2023年12⽉1⽇〜2024年3⽉31⽇)
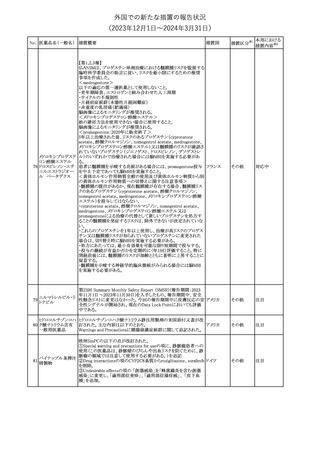
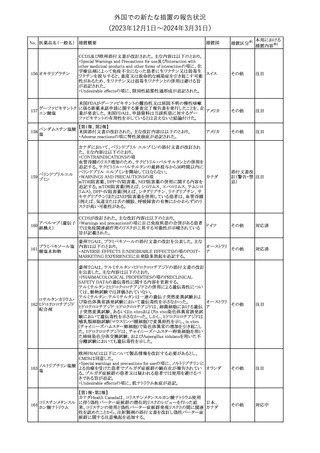
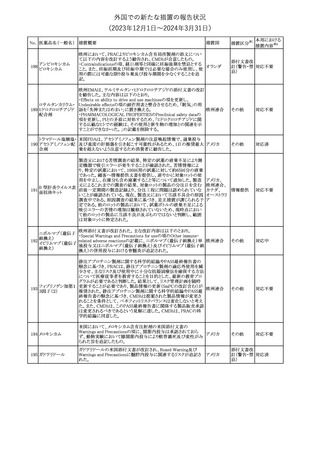
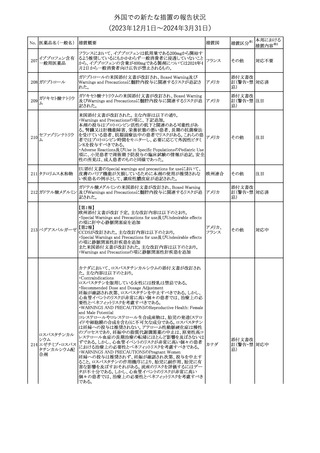
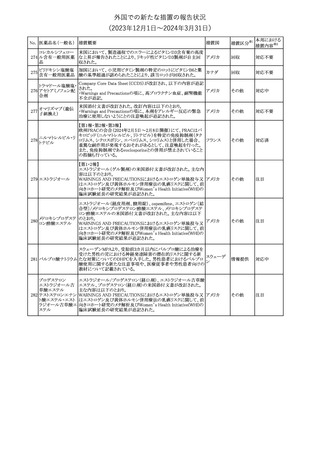
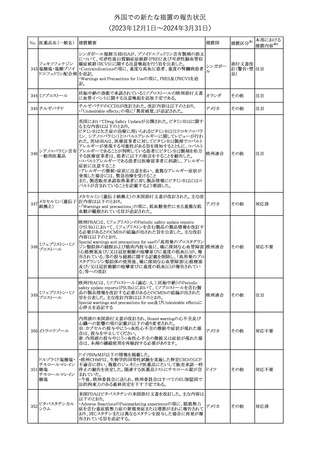
No. 医薬品名(一般名) 措置概要
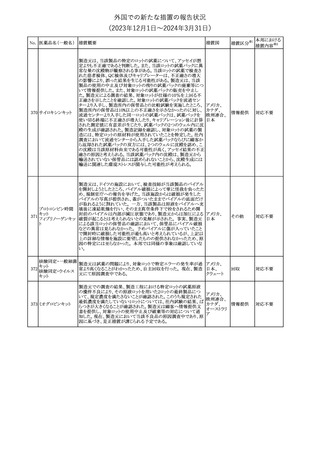
175
措置国
ニュージーランドにおいて製造販売企業より医療従事者向けのレ
ニルマトレルビル・リ
ターが出されたもの。併用禁忌の医薬品にエプレレノン、エレトリプ
トナビル
タン、naloxegol、トルバプタン、プリミドンが追記された。
措置区分※1
ニュージー
その他
ランド
本邦における
措置内容※2
注目
ピタバスタチンカル
シウム
176 ピタバスタチンカル
シウム水和物・エゼ
チミブ配合剤
米国FDAは、ピタバスタチンカルシウムの添付文書の改訂を勧告し
た。主な内容は以下のとおり。
・Adverse ReactionsのPostmarketing Experienceの項に、眼筋無力
アメリカ
症を含む重症筋無力症に関する内容を追記する。
・Adverse ReactionsのPostmarketing Experienceの項の認知障害に
関する情報を精神障害の項から神経系障害の項に移動する。
その他
注目
177 アキシチニブ
南アフリカ規制当局は、南アフリカで登録・販売されている遺伝毒性
を有する抗悪性腫瘍薬に対し、Professional Information /Patient
南アフリカ
Information Leafletの改訂及び避妊法の計算に関するDHCPレター
配布を勧告した。
情報提供
対応済
米国FDAは、デノスマブ(遺伝子組換え)(骨粗鬆症の効能・効果を
有する製剤)について、Drug Safety Communicationを発出し、FDA
がレビューを実施した結果、進行性慢性腎臓病 (CKD)患者、特に
CKDに伴う骨ミネラル代謝異常(CKD-MBD)患者において、本剤が
重度の低カルシウム血症、重度の血中カルシウム濃度低下のリスク
を高めると結論付けた旨を公表した。
また、本結果に基づき米国添付文書が改訂された。主な改訂内容
は以下のとおり。
・Boxed warningの項に「進行性腎臓病患者における重度の低カル
シウム血症」が追加され、eGFR<30 mL/min/1.73 m2の患者では低
デノスマブ(遺伝子 カルシウム血症のリスクが高くなる旨、特にCKD-MBDがあるとリスク
178
アメリカ
組換え)
が高くなる旨、進行性腎臓病患者においては投与開始前にCKDMBDの有無を評価すること等が追記された。
・Warnings and precautionsの項に「重度の低カルシウム血症とミネラ
ル代謝の変化」が追加され、本剤開始前に低カルシウム血症の治
療を行うこと、低カルシウム血症の素因のある患者では血清カルシウ
ム及び電解質のモニタリングを行うこと、進行性慢性腎臓病患者で
は特に低カルシウム血症のリスクが高いこと並びに定期的なモニタリ
ング及びカルシウムと活性型ビタミンDの補給が必要である旨等が
追記された。
・Use in specific populationsの「Renal impairment」の項に、上記に
関連した記載が追記された。
添付文書改
訂(警告・禁 注目
忌)
提携会社よりフェンタニルクエン酸塩(舌下錠)のEU RMPを当局に
提出したとの情報を入手した。変更点の概要は以下のとおり。
・偶発的曝露をimportant potential risksからimportant identified
オランダ
risksへ再分類すること
・リスク最小化措置に過量投与の懸念に関しPackage warning(外箱
への警告追記)を追加すること
その他
対応済
CCDSが改訂された。主な改訂内容は以下のとおり。
・Special Warnings and Precautions for useの項に、重篤な皮膚有害
反応(Severe cutaneous adverse reactions)が記載された。
180 ゲムシタビン塩酸塩 ・Undesirable effectsの項の表の「skin reactions」が「severe skin
アメリカ
reactions」に変更された。該当の表にはスティーブンス・ジョンソン症
候群、中毒性表皮壊死融解症、急性汎発性発疹性膿疱症、落屑及
び水疱性皮膚発疹の記載がある。
その他
注目
欧州CMDhは、非介入的な承認後安全性試験(PASS)の結果を検
クロルマジノン酢酸
討した結果、クロルマジノン酢酸エステル、エチニルエストラジオー
エステル
ル含有医薬品の添付文書改訂及び販売承認条件の変更(RMPの
181 ノルエチステロン・エ
欧州連合
更新)を勧告した。添付文書改訂の主な内容は以下のとおり。
チニルエストラジ
Special warning and precautions for useの静脈血栓塞栓症に関する
オール
記載の改訂
その他
対応済
回収
対応不要
179
182
フェンタニルクエン
酸塩
ホスアプレピタントメ 米国において、ホスアプレピタントの一部ロットについて、無菌性が
グルミン
担保されていないことから回収が行われた。
31
アメリカ