よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
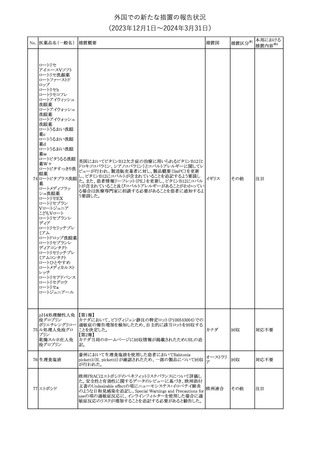
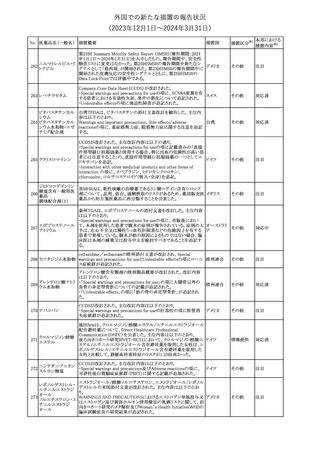
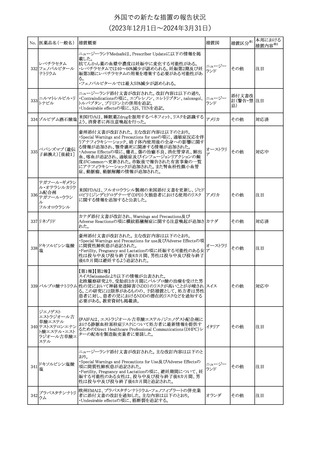
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
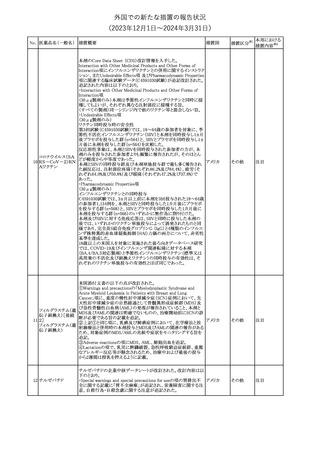
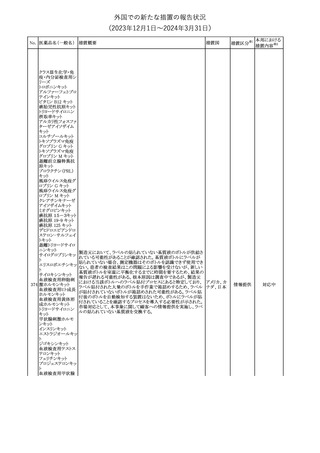
本剤のCore Data Sheet (CDS)改訂情報を入手した。
Interaction with Other Medicinal Products and Other Forms of
Interaction項にインフルエンザワクチンとの併用に関するインストラク
ション、またUndesirable Effects項 及びPharmacodynamic Properties
項に関連する臨床試験データ(C4591030試験)が追記改訂された。
追記された内容は以下のとおり。
・Interaction with Other Medicinal Products and Other Forms of
Interaction項
(30μg製剤のみ)本剤は季節性インフルエンザワクチンと同時に接
種してもよいが、それぞれ異なる注射部位に接種する旨。
(すべての製剤)同一シリンジ内で他のワクチン等と混合しない旨。
・Undesirable Effects項
(30μg製剤のみ)
ワクチン同時投与時の安全性
第3相試験(C4591030試験)では、18~64歳の参加者を対象に、季
節性不活化インフルエンザワクチン(SIIV)と本剤を同時投与し1ヵ月
後プラセボを投与した群(n=564)と、SIIVとプラセボを同時投与し1ヵ
月後に本剤を投与した群(n=564)を比較した。
反応原性事象は、本剤とSIIVを同時投与された参加者の方が、本
剤のみを投与された参加者よりも頻繁に報告されたが、そのほとん
コロナウイルス(SA
どが軽度から中等度であった。
10 RS-CoV-2)RN
アメリカ
本剤とSIIVの同時投与群及び本剤単独投与群で最も多く報告され
Aワクチン
た副反応は、注射部位疼痛(それぞれ86.2%及び84.4%)、疲労(そ
れぞれ64.0%及び50.8%)及び頭痛(それぞれ47.2%及び37.8%)で
あった。
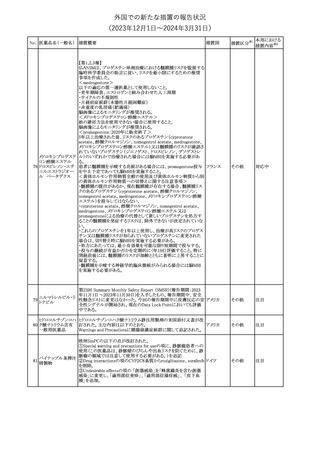
・Pharmacodynamic Properties項
(30μg製剤のみ)
インフルエンザワクチンとの同時投与
C4591030試験では、3ヵ月以上前に本剤を3回投与された18~64歳
の参加者1,134例を、本剤とSIIVと同時投与した1カ月後にプラセボ
を投与する群(n=568)と、SIIVとプラセボを同時投与した1カ月後に
本剤を投与する群(n=566)のいずれかに無作為に割り付けた。
本剤及びSIIVに対する免疫応答は、SIIVと同時に投与した本剤の
後では、いずれかのワクチン単独投与によって誘発されたものと同
様であり、完全長S結合免疫グロブリンG (IgG)と4種類のインフルエ
ンザ株特異的赤血球凝集抑制(HAI)力価の両方について、非劣性
基準を達成した。
18歳以上の米国人を対象に実施された後ろ向きデータベース研究
では、COVID-19及びインフルエンザ関連転帰に対する本剤
(BA.4/BA.5対応製剤)と季節性インフルエンザワクチン(標準又は
高用量の不活化及び組換えワクチン)の同時投与の有効性は、そ
れぞれのワクチン単独投与の有効性とほぼ同じであった。
その他
注目
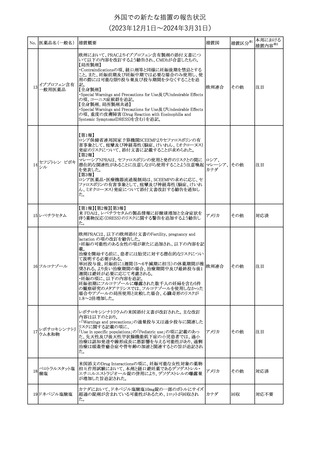
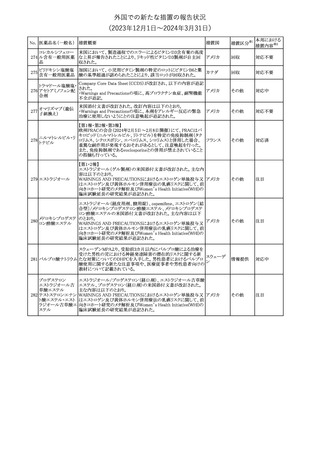
米国添付文書の以下の点が改訂された。
①Warnings and precautionsの「Myelodysplastic Syndrome and
Acute Myeloid Leukemia in Patients with Breast and Lung
Cancer」項に、重度の慢性好中球減少症(SCN)症例において、先
天性好中球減少症の自然経過として骨髄異形成症候群(MDS)及
び急性骨髄性白血病(AML)の発現が報告されていること、本剤と
フィルグラスチム(遺
MDS及びAMLの関連は明確でないものの、治療開始前にSCNの診
伝子組換え)[後続
断が必要である旨の記載を追記。
11 2]
アメリカ
②上記①と同じ項に、乳癌及び肺癌症例において、化学療法と放
フィルグラスチム(遺
射線療法と併用時の本剤投与とMDS及びAMLの関連の報告がある
伝子組換え)
ため、対象症例のMDS/AMLの兆候や症状をモニタリングする旨を
追記。
③Adverse reactionsの項にMDS、AML、肺胞出血を追記。
④Lactationの項で、乳児に脾臓破裂、急性呼吸窮迫症候群、重篤
なアレルギー反応等が懸念されるため、治療中および最後の投与
から2週間は授乳を控えるように記載。
その他
注目
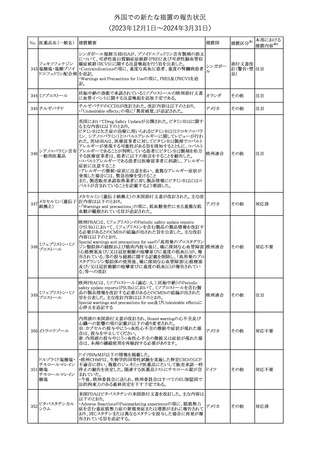
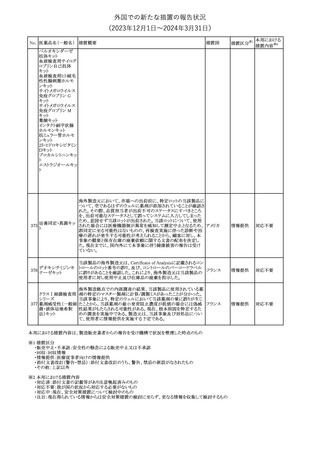
チルゼパチドの企業中核データシートが改訂された。改訂内容は以
下のとおり。
・Special warnings and special precautions for useの項の胃排出不 アメリカ
全に関する記載に「胃不全麻痺」が追記され、栄養障害に関する注
意、自殺行為・自殺念慮に関する注意が追記された。
その他
注目
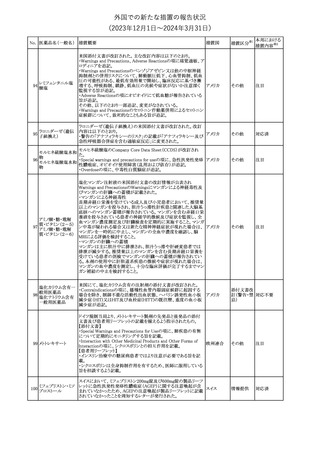
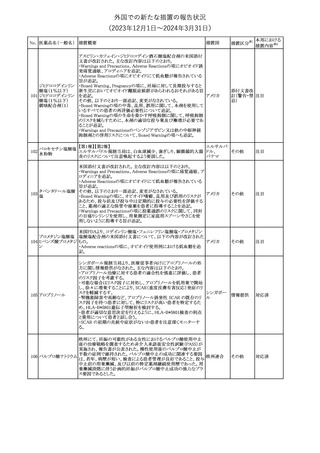
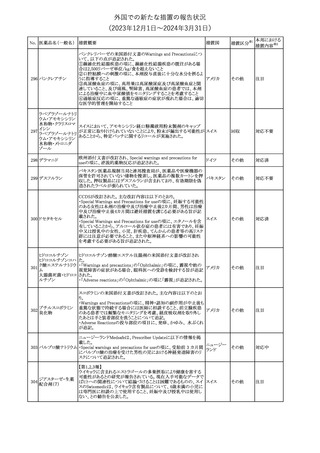
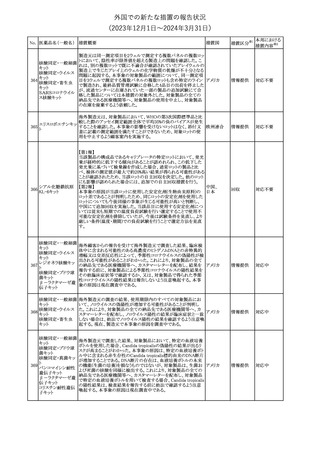
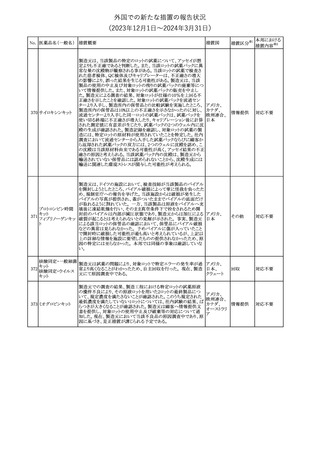
No. 医薬品名(一般名) 措置概要
12 チルゼパチド
措置国
3
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
本剤のCore Data Sheet (CDS)改訂情報を入手した。
Interaction with Other Medicinal Products and Other Forms of
Interaction項にインフルエンザワクチンとの併用に関するインストラク
ション、またUndesirable Effects項 及びPharmacodynamic Properties
項に関連する臨床試験データ(C4591030試験)が追記改訂された。
追記された内容は以下のとおり。
・Interaction with Other Medicinal Products and Other Forms of
Interaction項
(30μg製剤のみ)本剤は季節性インフルエンザワクチンと同時に接
種してもよいが、それぞれ異なる注射部位に接種する旨。
(すべての製剤)同一シリンジ内で他のワクチン等と混合しない旨。
・Undesirable Effects項
(30μg製剤のみ)
ワクチン同時投与時の安全性
第3相試験(C4591030試験)では、18~64歳の参加者を対象に、季
節性不活化インフルエンザワクチン(SIIV)と本剤を同時投与し1ヵ月
後プラセボを投与した群(n=564)と、SIIVとプラセボを同時投与し1ヵ
月後に本剤を投与した群(n=564)を比較した。
反応原性事象は、本剤とSIIVを同時投与された参加者の方が、本
剤のみを投与された参加者よりも頻繁に報告されたが、そのほとん
コロナウイルス(SA
どが軽度から中等度であった。
10 RS-CoV-2)RN
アメリカ
本剤とSIIVの同時投与群及び本剤単独投与群で最も多く報告され
Aワクチン
た副反応は、注射部位疼痛(それぞれ86.2%及び84.4%)、疲労(そ
れぞれ64.0%及び50.8%)及び頭痛(それぞれ47.2%及び37.8%)で
あった。
・Pharmacodynamic Properties項
(30μg製剤のみ)
インフルエンザワクチンとの同時投与
C4591030試験では、3ヵ月以上前に本剤を3回投与された18~64歳
の参加者1,134例を、本剤とSIIVと同時投与した1カ月後にプラセボ
を投与する群(n=568)と、SIIVとプラセボを同時投与した1カ月後に
本剤を投与する群(n=566)のいずれかに無作為に割り付けた。
本剤及びSIIVに対する免疫応答は、SIIVと同時に投与した本剤の
後では、いずれかのワクチン単独投与によって誘発されたものと同
様であり、完全長S結合免疫グロブリンG (IgG)と4種類のインフルエ
ンザ株特異的赤血球凝集抑制(HAI)力価の両方について、非劣性
基準を達成した。
18歳以上の米国人を対象に実施された後ろ向きデータベース研究
では、COVID-19及びインフルエンザ関連転帰に対する本剤
(BA.4/BA.5対応製剤)と季節性インフルエンザワクチン(標準又は
高用量の不活化及び組換えワクチン)の同時投与の有効性は、そ
れぞれのワクチン単独投与の有効性とほぼ同じであった。
その他
注目
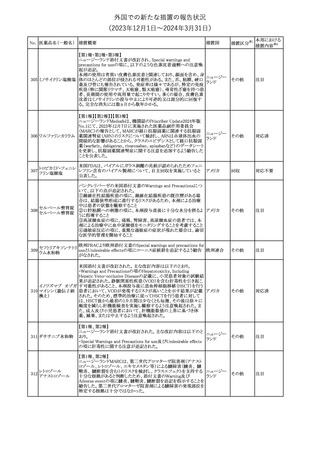
米国添付文書の以下の点が改訂された。
①Warnings and precautionsの「Myelodysplastic Syndrome and
Acute Myeloid Leukemia in Patients with Breast and Lung
Cancer」項に、重度の慢性好中球減少症(SCN)症例において、先
天性好中球減少症の自然経過として骨髄異形成症候群(MDS)及
び急性骨髄性白血病(AML)の発現が報告されていること、本剤と
フィルグラスチム(遺
MDS及びAMLの関連は明確でないものの、治療開始前にSCNの診
伝子組換え)[後続
断が必要である旨の記載を追記。
11 2]
アメリカ
②上記①と同じ項に、乳癌及び肺癌症例において、化学療法と放
フィルグラスチム(遺
射線療法と併用時の本剤投与とMDS及びAMLの関連の報告がある
伝子組換え)
ため、対象症例のMDS/AMLの兆候や症状をモニタリングする旨を
追記。
③Adverse reactionsの項にMDS、AML、肺胞出血を追記。
④Lactationの項で、乳児に脾臓破裂、急性呼吸窮迫症候群、重篤
なアレルギー反応等が懸念されるため、治療中および最後の投与
から2週間は授乳を控えるように記載。
その他
注目
チルゼパチドの企業中核データシートが改訂された。改訂内容は以
下のとおり。
・Special warnings and special precautions for useの項の胃排出不 アメリカ
全に関する記載に「胃不全麻痺」が追記され、栄養障害に関する注
意、自殺行為・自殺念慮に関する注意が追記された。
その他
注目
No. 医薬品名(一般名) 措置概要
12 チルゼパチド
措置国
3