よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
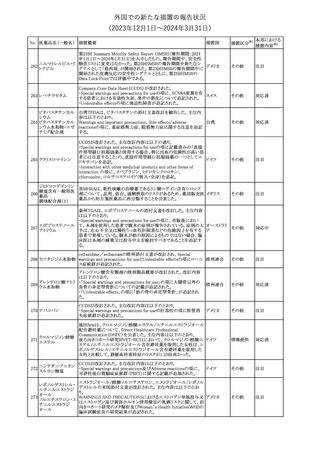
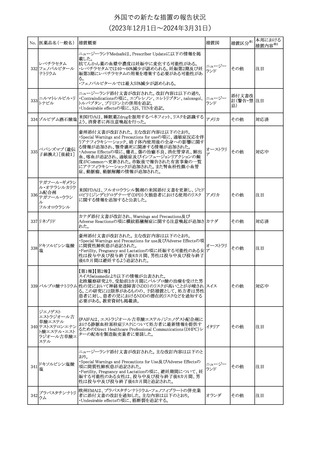
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
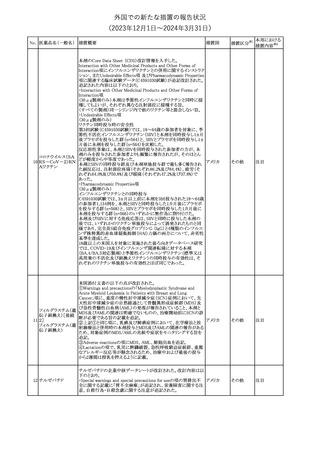
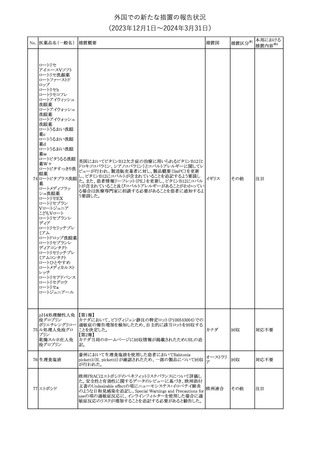
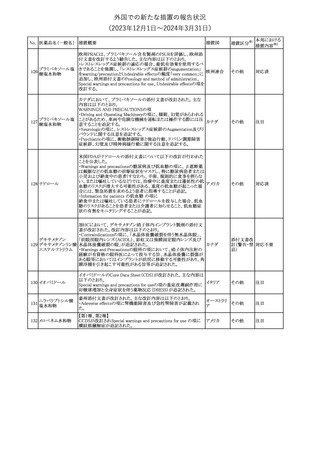
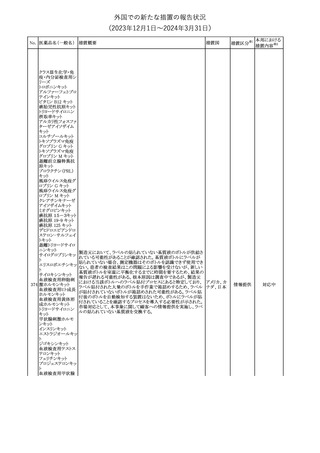
No. 医薬品名(一般名) 措置概要
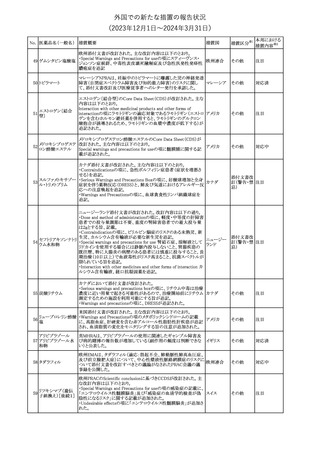
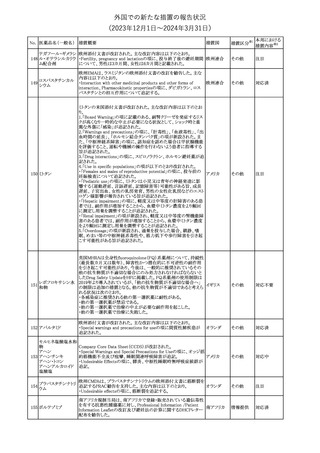
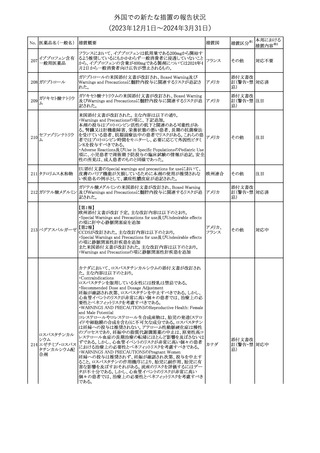
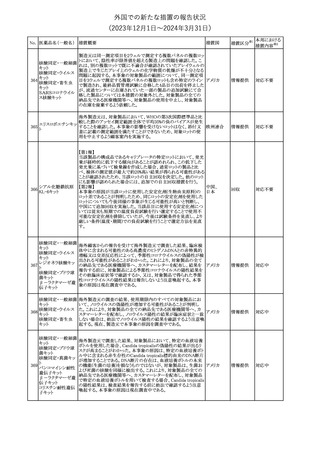
措置国
米国FDAは、ピタバスタチンの添付文書を改訂した。主な内容は以
下のとおり。
Indications and usage
①「本剤は原発性高脂血症または混合型脂質異常症の成人患者に
おいて、総コレステロール(TC)、低密度リポ蛋白質コレステロール
(LDL-C)、アポリポ蛋白質B (Apo B)、トリグリセリド(TG)、および高密
度リポ蛋白質コレステロール(HDL-C)を低下させるための食事療法
の補助療法として適応となる」から「本剤は、原発性高脂血症の成人
における低密度リポ蛋白質コレステロール(LDL-C)を低下させる食
事療法の補助として適応となる」に変更し、使用の制限の「心血管系
罹病率および死亡率に対する本剤の影響は明らかにされていな
い。」を削除する。
Dosage and administration
②用法・用量を現行の表示方法と整合させる。
Contraindications
③妊婦、授乳婦を削除する。
④「活動性肝疾患または肝トランスアミナーゼレベルの原因不明の
持続的上昇」から「急性肝不全または非代償性肝硬変」に変更す
る。
Warnings and Precautions
⑤免疫介在性壊死性ミオパチー(IMNM)の項を更新し、自己免疫
性ミオパチーである免疫介在性壊死性ミオパシー(IMNM)は、スタチ
ン使用に関連し、同じまたは異なるスタチンが投与された場合の再
発の報告を含むまれな報告があること、IMNM が疑われる場合は、
ピタバスタチンカル
225
本剤を中止することを追記する。
アメリカ
シウム
Adverse Reactions
⑥Postmarketing experienceの項に、眼筋無力症を含む重症筋無力
症の新規発症または増悪がまれに報告されており、同じスタチンま
たは異なるスタチンを投与した場合に再発が報告されている旨、扁
平苔癬を追記する。
Use in specific populations
⑦妊婦の項をPLLR従い更新し、「妊婦には禁忌である」から「妊娠
が判明した場合は投与を中止すること。あるいは、個々の患者にお
ける継続的な治療の必要性を考慮すること」に変更する。
⑧授乳婦の項をPLLRに従い更新し、「授乳中は禁忌である」から
「本剤投与中の授乳は推奨されない」に変更する。
⑨小児の項を更新し、「ヘテロ接合型家族性高コレステロール血症
(HeFH)の8歳未満の小児患者およびその他の高脂血症(HeFH以
外)の小児患者における本剤の安全性および有効性は確立されて
いない。」から「小児等に対する安全性及び有効性は確立していな
い。」に変更する。
⑩肝障害の項を更新し、禁忌の「活動性肝疾患または肝トランスアミ
ナーゼレベルの原因不明の持続的上昇」から「急性肝不全または非
代償性肝硬変」に変更する。
Nonclinical toxicology
⑪これらの知見の臨床的意義を検討するのに十分なヒトのデータが
利用可能であることに基づいて、「動物における毒性および薬理学」
を削除する。
39
措置区分※1
本邦における
措置内容※2
添付文書改
訂(警告・禁 対応中
忌)
(2023年12⽉1⽇〜2024年3⽉31⽇)
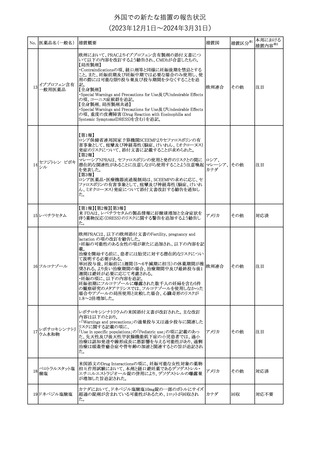
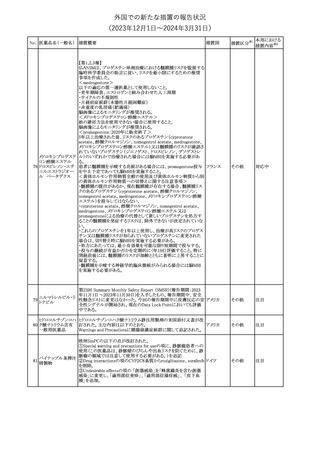
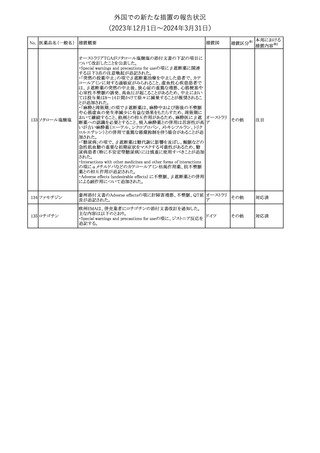
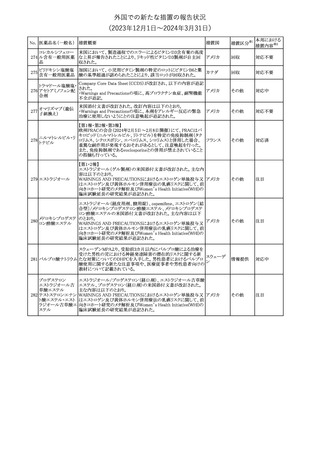
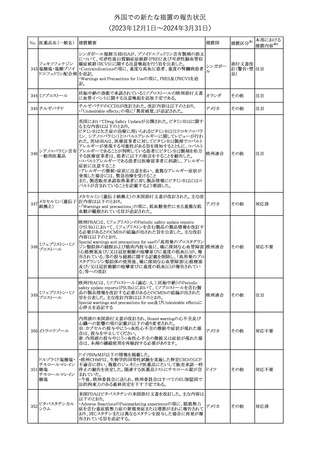
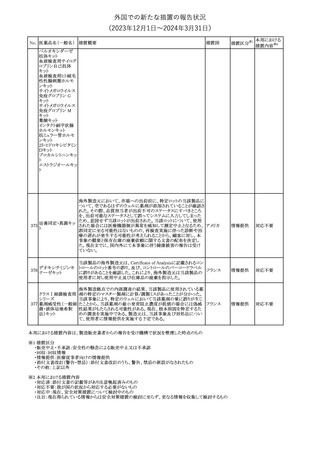
No. 医薬品名(一般名) 措置概要
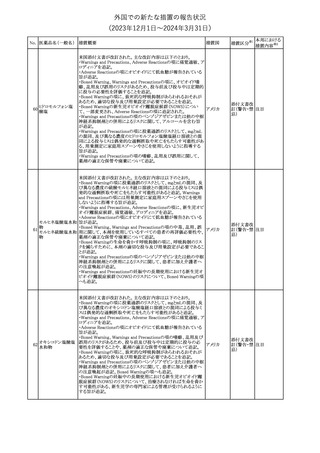
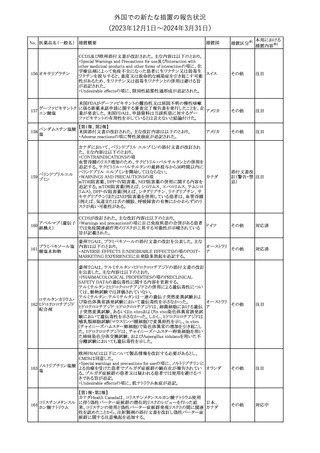
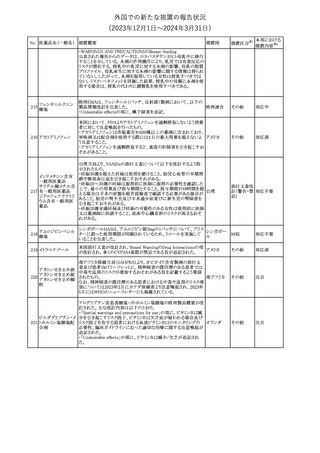
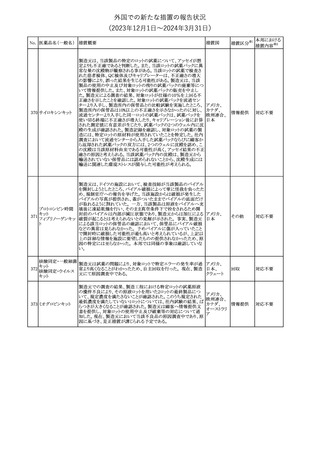
措置国
米国FDAは、ピタバスタチンの添付文書を改訂した。主な内容は以
下のとおり。
Indications and usage
①「本剤は原発性高脂血症または混合型脂質異常症の成人患者に
おいて、総コレステロール(TC)、低密度リポ蛋白質コレステロール
(LDL-C)、アポリポ蛋白質B (Apo B)、トリグリセリド(TG)、および高密
度リポ蛋白質コレステロール(HDL-C)を低下させるための食事療法
の補助療法として適応となる」から「本剤は、原発性高脂血症の成人
における低密度リポ蛋白質コレステロール(LDL-C)を低下させる食
事療法の補助として適応となる」に変更し、使用の制限の「心血管系
罹病率および死亡率に対する本剤の影響は明らかにされていな
い。」を削除する。
Dosage and administration
②用法・用量を現行の表示方法と整合させる。
Contraindications
③妊婦、授乳婦を削除する。
④「活動性肝疾患または肝トランスアミナーゼレベルの原因不明の
持続的上昇」から「急性肝不全または非代償性肝硬変」に変更す
る。
Warnings and Precautions
⑤免疫介在性壊死性ミオパチー(IMNM)の項を更新し、自己免疫
性ミオパチーである免疫介在性壊死性ミオパシー(IMNM)は、スタチ
ン使用に関連し、同じまたは異なるスタチンが投与された場合の再
発の報告を含むまれな報告があること、IMNM が疑われる場合は、
ピタバスタチンカル
225
本剤を中止することを追記する。
アメリカ
シウム
Adverse Reactions
⑥Postmarketing experienceの項に、眼筋無力症を含む重症筋無力
症の新規発症または増悪がまれに報告されており、同じスタチンま
たは異なるスタチンを投与した場合に再発が報告されている旨、扁
平苔癬を追記する。
Use in specific populations
⑦妊婦の項をPLLR従い更新し、「妊婦には禁忌である」から「妊娠
が判明した場合は投与を中止すること。あるいは、個々の患者にお
ける継続的な治療の必要性を考慮すること」に変更する。
⑧授乳婦の項をPLLRに従い更新し、「授乳中は禁忌である」から
「本剤投与中の授乳は推奨されない」に変更する。
⑨小児の項を更新し、「ヘテロ接合型家族性高コレステロール血症
(HeFH)の8歳未満の小児患者およびその他の高脂血症(HeFH以
外)の小児患者における本剤の安全性および有効性は確立されて
いない。」から「小児等に対する安全性及び有効性は確立していな
い。」に変更する。
⑩肝障害の項を更新し、禁忌の「活動性肝疾患または肝トランスアミ
ナーゼレベルの原因不明の持続的上昇」から「急性肝不全または非
代償性肝硬変」に変更する。
Nonclinical toxicology
⑪これらの知見の臨床的意義を検討するのに十分なヒトのデータが
利用可能であることに基づいて、「動物における毒性および薬理学」
を削除する。
39
措置区分※1
本邦における
措置内容※2
添付文書改
訂(警告・禁 対応中
忌)