よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (55 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
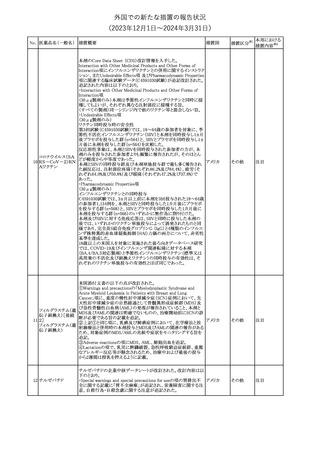
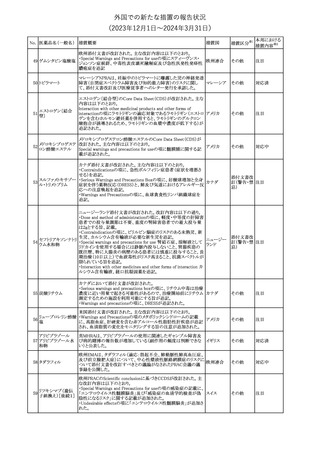
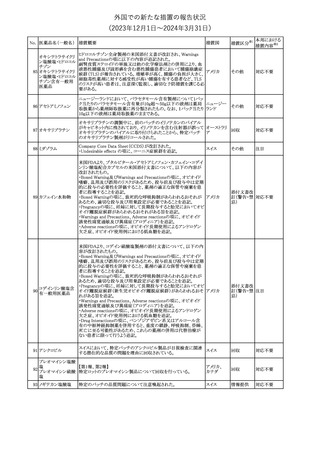
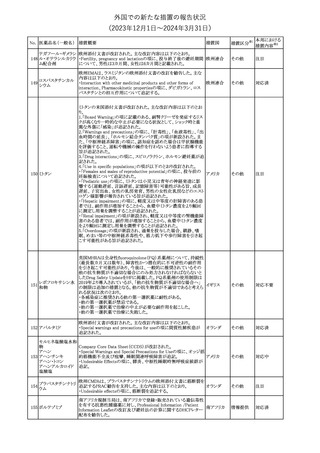
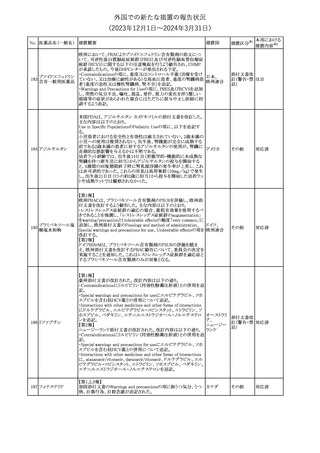
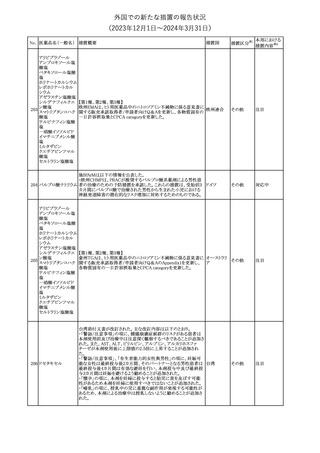
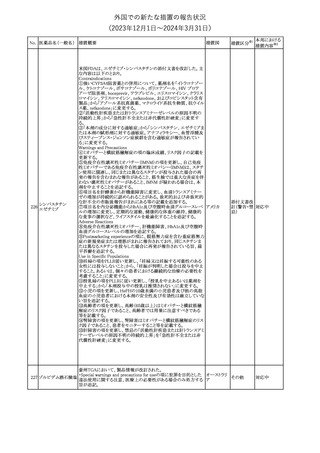
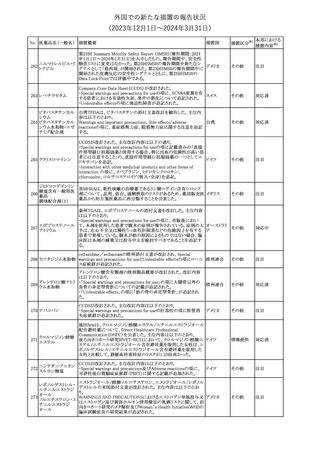
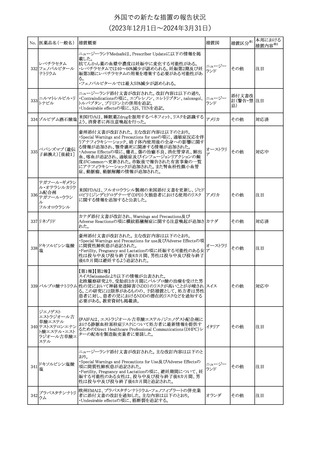
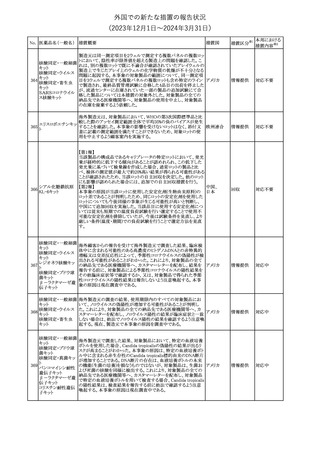
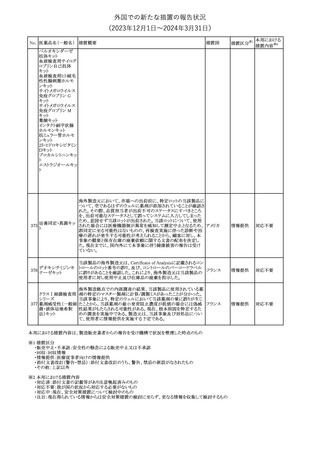
No. 医薬品名(一般名) 措置概要
353 バクロフェン
措置国
措置区分※1
豪州TGAにおいて、製品情報が改訂された。
・Special warnings and precautions for useの項に、(髄腔内投与)離
脱症状としての頻脈、消化性潰瘍の病歴のある患者に対する注意、
(経口剤)離脱症状として筋緊張亢進を追記。
オーストラリ
・Interactions with other medicines and other forms of interactions
その他
ア
の項に、降圧薬。
・Adverse effectsの項に、過敏症、(経口剤のみ)顔面浮腫、末梢浮
腫、脱毛症、性機能障害。
・Overdoseの項に、頻脈、耳鳴。
ドルゾラミド塩酸塩・
チモロールマレイン
米国FDAは、無菌性保証欠如のためチモロール点眼液0.5%
354 酸塩
(15mL)について、クラスⅡの自主回収を実施していると公表した。
チモロールマレイン
酸塩
注目
回収
対応不要
加HCは、エゼチミブの薬物性肝障害(DILI)、スティーヴンス・ジョン
ソン症候群(SJS)、中毒性表皮壊死融解症(TEN)、および好酸球増
加と全身症状を伴う薬物反応(DRESS)を含む重症皮膚副作用
(SCARs)のリスクについて医療従事者に注意喚起した。
カナダ
また、カナダ添付文書を改訂し、Serious Warnings and precautions
box、Warnings and precautions、Adverse ReactionsのPost-Market
Adverse Reactionsの項に、薬物性肝障害(DILI)、SJS、TEN、
DRESSを含む重症皮膚副作用(SCARs)を追記した。
その他
注目
CDSのSpecial Warnings and Special Precautions for Useの項に過
敏症、寄生虫感染症に関する以下の注意事項が追記されたもの。
・過敏症反応が報告されていることから、重篤な過敏症反応が現れ
レブリキズマブ(遺伝 た場合は投与中止し、適切な処置を行うこと。
356
アメリカ
子組換え)
・本剤が寄生虫感染症に対する免疫応答に与える影響は不明であ
る。本剤投与開始前に、寄生虫感染症を治療する。投与中に感染
し、駆虫薬治療では改善がみられない場合は、感染症が治るまで本
剤の投与を中止すること。
その他
注目
ニュージーランドMedsafeは、Prescriber Updateに以下の情報を掲
載した。
ニュージー
その他
357 オクスカルバゼピン ・Fertility, pregnancy and lactationの項に、妊娠に関してEURAPレ
ランド
ジストリの結果から先天性奇形と神経発達障害の可能性があること、
授乳時の乳児の曝露が記載された。
注目
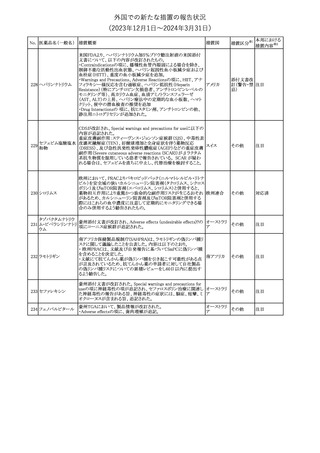
【第1報】
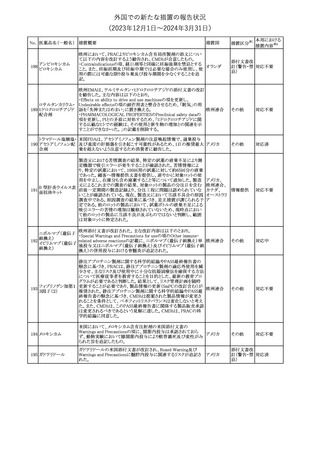
製造元にて実施した安定性試験において、免疫染色試薬の製造後
14ヵ月の一部ロットの染色の弱化傾向が確認された。染色の弱化傾
向を受けて製造元では予防的に対象ロットの使用中止と、使用期限
を14ヵ月に短縮し14ヵ月を超過して実施した検査は必要に応じて再
検査を顧客案内する措置を決定した。 本事象に関する調査は継続
中であるが、事象が確認されたロットの原材料において、抗体力価
アメリカ、
が通常よりも低いことが判明した。尚、特定の原材料を用いて製造さ
イギリス、
れたロット以外は実染色試験により当該事象の影響を受けないこと
B型肝炎ウイルス表
フランス、
情報提供
358
を確認している。また、製造元が全世界の苦情を確認したところ、製
オーストラリ
面抗体キット
造元から案内発出時点までに、本事象に関連する苦情は確認され
ア、
ていない。
日本
【第2報】
製造元の調査の結果、本事象は経時的に反応性が低下することに
起因しており、当該原材料の受け入れ試験および製品の出荷前試
験では検出できず、いずれも規格を満たしていた。製造元では、特
定の原材料について、ロットごとに臨床検体を用いた安定性試験を
追加し、製品の使用期限までの各段階においてモニターする予定
である。
注目
製造元の内部の調査で、当該製品の対象ロットの一部のキットで特
核酸同定・一般細菌
定の酵素の分注量が少ないことがわかった。これにより偽陰性となる
キット
可能性があるため対象ロットの使用中止と廃棄について、顧客に対
核酸同定・ブドウ球
アメリカ、
359
し情報提供を実施した。製造元で在庫保管ロットをすべて検査し、
菌キット
日本
当該酵素の分注量が少ないものが対象ロットのみであることを確認
バンコマイシン耐性
した。製造元にて原因を調査中であるが、一時的な対応として、製
遺伝子キット
造元の製造工程において分注量の検査数を増加している。
対応不要
355 エゼチミブ
55
アメリカ
本邦における
措置内容※2
情報提供
(2023年12⽉1⽇〜2024年3⽉31⽇)
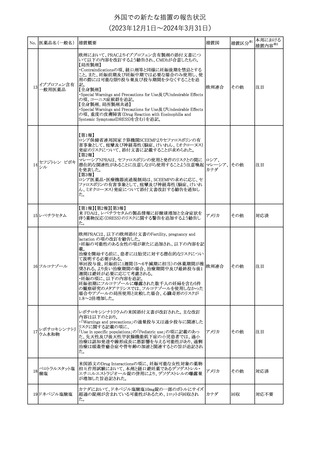
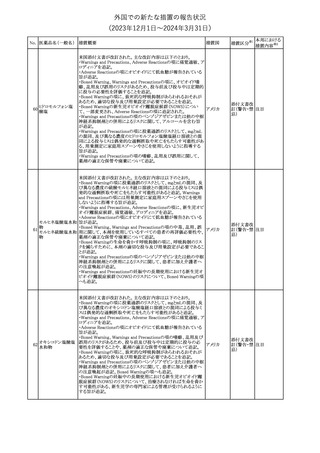
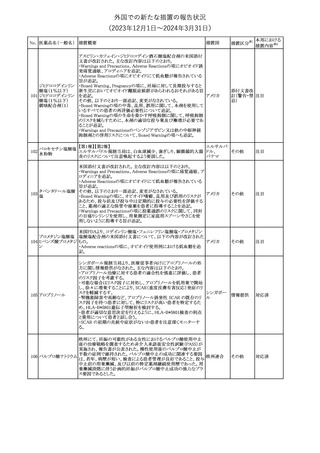
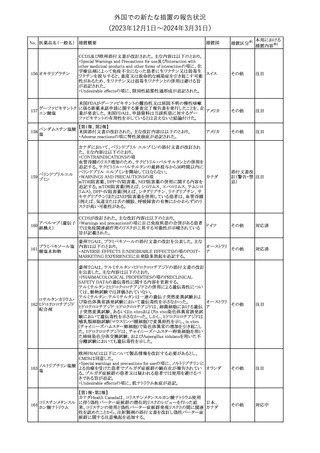
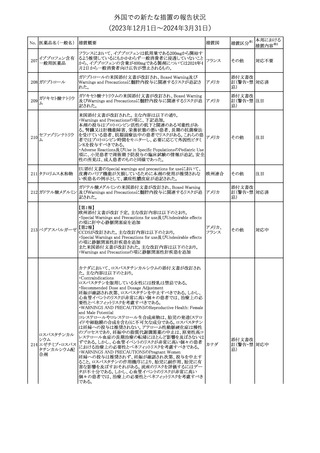
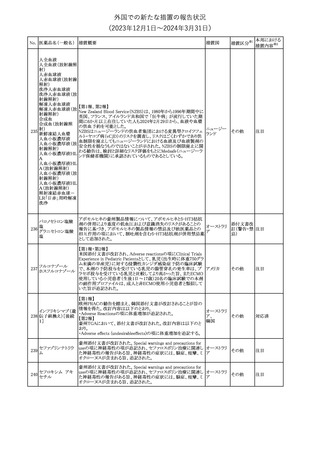
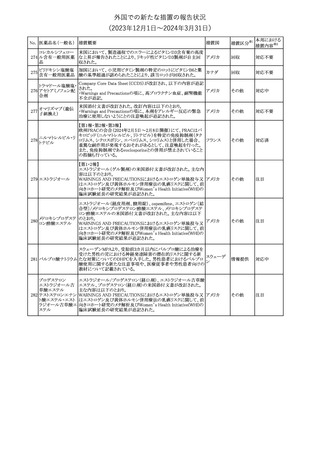
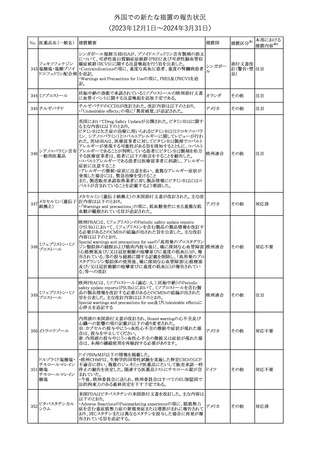
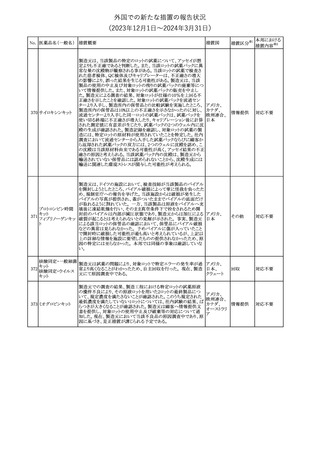
No. 医薬品名(一般名) 措置概要
353 バクロフェン
措置国
措置区分※1
豪州TGAにおいて、製品情報が改訂された。
・Special warnings and precautions for useの項に、(髄腔内投与)離
脱症状としての頻脈、消化性潰瘍の病歴のある患者に対する注意、
(経口剤)離脱症状として筋緊張亢進を追記。
オーストラリ
・Interactions with other medicines and other forms of interactions
その他
ア
の項に、降圧薬。
・Adverse effectsの項に、過敏症、(経口剤のみ)顔面浮腫、末梢浮
腫、脱毛症、性機能障害。
・Overdoseの項に、頻脈、耳鳴。
ドルゾラミド塩酸塩・
チモロールマレイン
米国FDAは、無菌性保証欠如のためチモロール点眼液0.5%
354 酸塩
(15mL)について、クラスⅡの自主回収を実施していると公表した。
チモロールマレイン
酸塩
注目
回収
対応不要
加HCは、エゼチミブの薬物性肝障害(DILI)、スティーヴンス・ジョン
ソン症候群(SJS)、中毒性表皮壊死融解症(TEN)、および好酸球増
加と全身症状を伴う薬物反応(DRESS)を含む重症皮膚副作用
(SCARs)のリスクについて医療従事者に注意喚起した。
カナダ
また、カナダ添付文書を改訂し、Serious Warnings and precautions
box、Warnings and precautions、Adverse ReactionsのPost-Market
Adverse Reactionsの項に、薬物性肝障害(DILI)、SJS、TEN、
DRESSを含む重症皮膚副作用(SCARs)を追記した。
その他
注目
CDSのSpecial Warnings and Special Precautions for Useの項に過
敏症、寄生虫感染症に関する以下の注意事項が追記されたもの。
・過敏症反応が報告されていることから、重篤な過敏症反応が現れ
レブリキズマブ(遺伝 た場合は投与中止し、適切な処置を行うこと。
356
アメリカ
子組換え)
・本剤が寄生虫感染症に対する免疫応答に与える影響は不明であ
る。本剤投与開始前に、寄生虫感染症を治療する。投与中に感染
し、駆虫薬治療では改善がみられない場合は、感染症が治るまで本
剤の投与を中止すること。
その他
注目
ニュージーランドMedsafeは、Prescriber Updateに以下の情報を掲
載した。
ニュージー
その他
357 オクスカルバゼピン ・Fertility, pregnancy and lactationの項に、妊娠に関してEURAPレ
ランド
ジストリの結果から先天性奇形と神経発達障害の可能性があること、
授乳時の乳児の曝露が記載された。
注目
【第1報】
製造元にて実施した安定性試験において、免疫染色試薬の製造後
14ヵ月の一部ロットの染色の弱化傾向が確認された。染色の弱化傾
向を受けて製造元では予防的に対象ロットの使用中止と、使用期限
を14ヵ月に短縮し14ヵ月を超過して実施した検査は必要に応じて再
検査を顧客案内する措置を決定した。 本事象に関する調査は継続
中であるが、事象が確認されたロットの原材料において、抗体力価
アメリカ、
が通常よりも低いことが判明した。尚、特定の原材料を用いて製造さ
イギリス、
れたロット以外は実染色試験により当該事象の影響を受けないこと
B型肝炎ウイルス表
フランス、
情報提供
358
を確認している。また、製造元が全世界の苦情を確認したところ、製
オーストラリ
面抗体キット
造元から案内発出時点までに、本事象に関連する苦情は確認され
ア、
ていない。
日本
【第2報】
製造元の調査の結果、本事象は経時的に反応性が低下することに
起因しており、当該原材料の受け入れ試験および製品の出荷前試
験では検出できず、いずれも規格を満たしていた。製造元では、特
定の原材料について、ロットごとに臨床検体を用いた安定性試験を
追加し、製品の使用期限までの各段階においてモニターする予定
である。
注目
製造元の内部の調査で、当該製品の対象ロットの一部のキットで特
核酸同定・一般細菌
定の酵素の分注量が少ないことがわかった。これにより偽陰性となる
キット
可能性があるため対象ロットの使用中止と廃棄について、顧客に対
核酸同定・ブドウ球
アメリカ、
359
し情報提供を実施した。製造元で在庫保管ロットをすべて検査し、
菌キット
日本
当該酵素の分注量が少ないものが対象ロットのみであることを確認
バンコマイシン耐性
した。製造元にて原因を調査中であるが、一時的な対応として、製
遺伝子キット
造元の製造工程において分注量の検査数を増加している。
対応不要
355 エゼチミブ
55
アメリカ
本邦における
措置内容※2
情報提供