よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
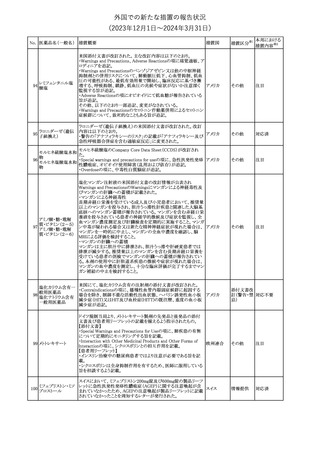
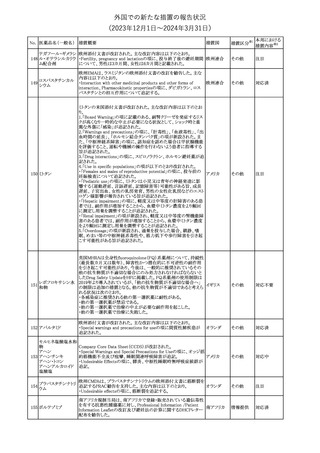
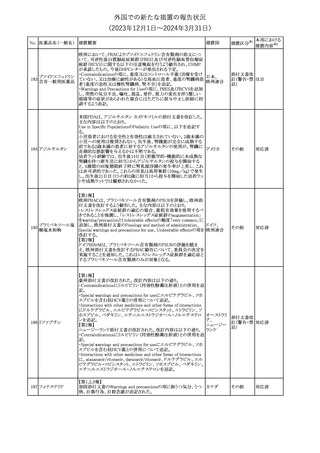
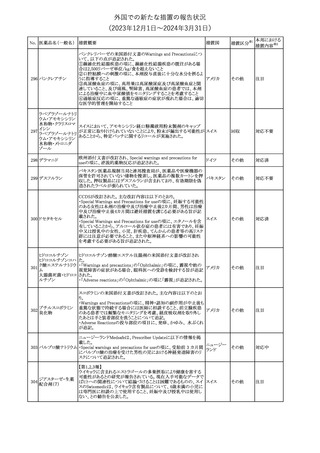
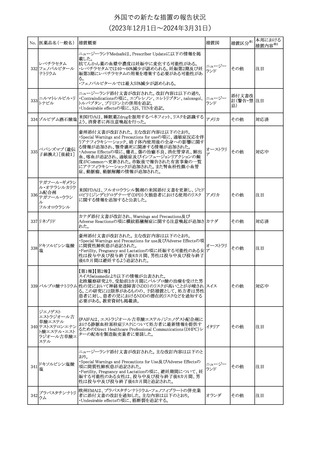
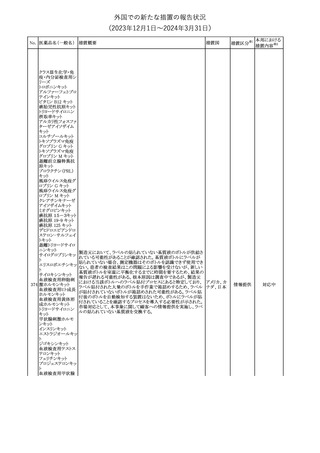
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
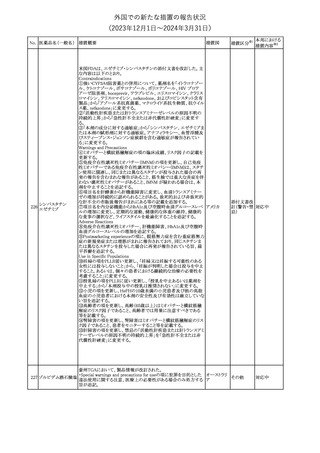
措置区分※1
本邦における
措置内容※2
【第1報】
本製品の特定ロットにおいて、別製品の特定ロットが梱包されている
との苦情を受け、製造元は各支社に、当該ロットの本製品及び別製
品の使用を中止し、廃棄するように指示した。
【第2報】
本事象の根本原因は、製造時に用いる特定のプリンタのIPアドレス
接続の問題により、作業中の製造用の印刷システムと別の製造ライ
ンの製造用の印刷システムの間で意図しない接続が生じ、本製品
の特定ロットで別製品の製品ラベルが混入したことである。措置対象
ロットについては、返送品等の調査により、本事象が確認されたロッ
トの製造時間と、IPアドレス接続の問題によりラベルの変更が発生し
た可能性のある製造時間について、製造時間及びカートン数が一
致することを確認したことから、1ロットに特定された。2023年よりラベ
培養同定 ・ 一般細 ル照合時にロット照合を可能にするためのアップグレードが実施さ
360
アメリカ
れ、これにより、本事象の発生を検出することができるようになった。
菌キット
なお、措置対象ロットの製造時にはこのアップグレードは有効でな
かったため、本事象が発生した。製造元は、各支社に、医療機関に
おいて措置対象ロット及び別製品の特定ロット製品を使用せず廃棄
する旨の情報提供を行うよう指示した。なお、本製品の措置対象ロッ
トは本邦に入荷しておらず、別製品については本邦での取扱いが
無いものである。
【第3報】
意図しないIPアドレスの接続の原因は関連するラインメンテナンス手
順書に、本事象が発生したカートナープリンターの交換方法と製造
現場での正しいIPアドレスの確立方法についての手順が文書化さ
れていなかったことである。再発防止策として、カートナープリンタの
設置および通信が正しいことの確認を含む新規の手順書を作成す
る予定である。
情報提供
対応不要
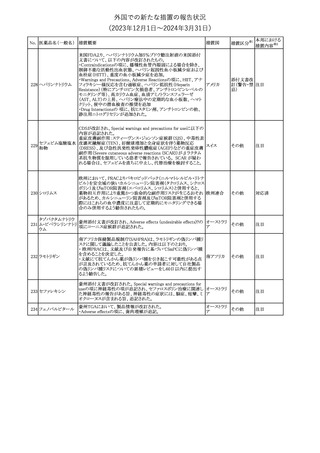
【第1報】
製造元で行われた当該製品使用における判定妨害の有無確認試
インスリン様成長因
験において、膣検体中の潤滑剤の存在が判定結果に干渉する可能
子結合蛋白1キット
性があり、使用説明書から逸脱していることが判明したため、加HC
腟分泌液中インスリ
は当該製品の全ロットがリコール(typeⅡ)されたことを公開した。
カナダ
361
ン様成長因子結合
【第2報】
蛋白1型(IGFBP-1)
リコール(typeⅡ)として、使用説明書が更新されるまでの間、顧客に
検出試薬
本情報を伝達するとともに、新しいキットにも情報提供文書を添付す
る。
情報提供
注目
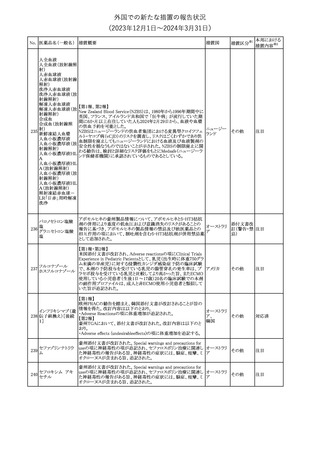
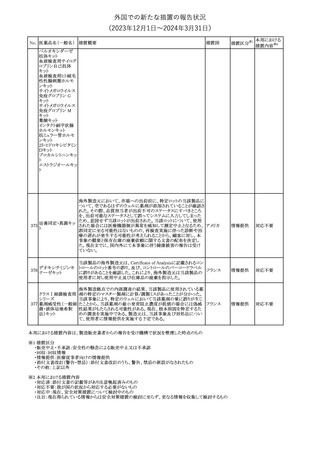
No. 医薬品名(一般名) 措置概要
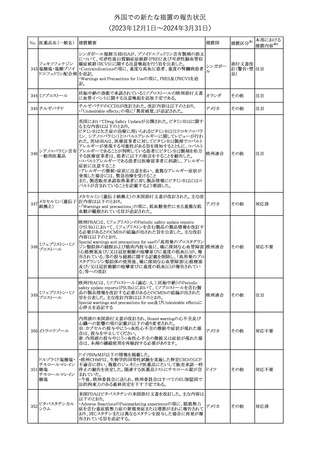
措置国
【第1報】
製造元において、当該製品を使用したHaemophilus influenzae およ
び Haemophilus parainfluenzaeの感受性測定結果にばらつきが認
められ、判定基準を満たさない可能性が判明した。調査の結果、製
造元は、当該製品の性能や品質に起因したものではなく、培地や菌
株などの複合的な要因により、検査結果にばらつきが生じている可
能性があると判断し、当該被検菌の薬剤感受性検査への当該製品
アメリカ、
薬剤感受性(一般細 の使用を中止するよう、顧客に対して情報提供することとした。
オーストラリ 情報提供
362
菌・ディスク法)キット 【第2報】
ア、カナダ
製造元において再現試験を実施したところ、所定の培地における当
該被検菌の増殖が悪く、阻止円の検出が困難であった。当該被検
菌以外の微生物に対しては、良好な性能を示すことが確認された。
なお、当該製品については出荷試験にて薬剤の力価を確認してい
る。製造元は、当該製品における薬剤感受性検査の被検菌から、当
該被検菌を除外することを決定し、顧客に対して情報提供することと
した。
対応中
海外製造元は、当該製品の特定ロット以降について、品質管理
(QC)および患者検体において、測定結果に負のバイアスが発生す
血液検査用免疫グ
363
る可能性を確認した。なお、2~8℃で冷蔵保存された未開封の試 欧州連合
ロブリンMキット
薬は影響を受けない。 海外製造元では現在原因の調査を行ってい
る。
対応中
56
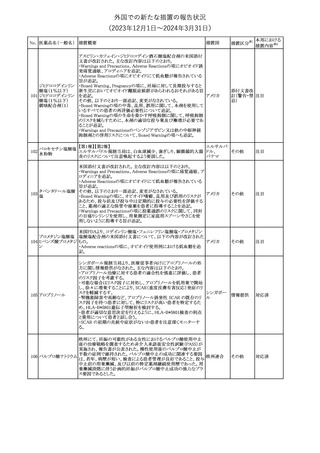
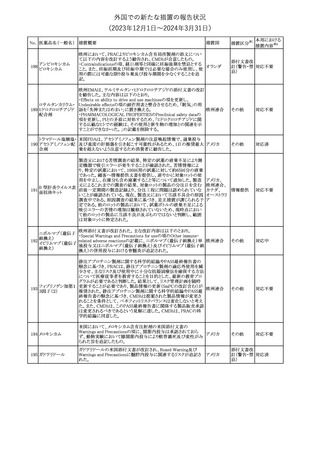
情報提供
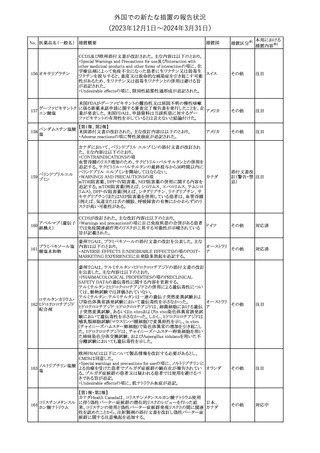
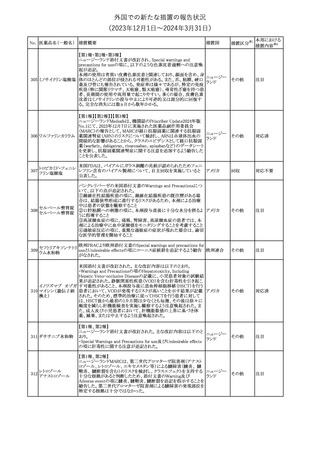
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
【第1報】
本製品の特定ロットにおいて、別製品の特定ロットが梱包されている
との苦情を受け、製造元は各支社に、当該ロットの本製品及び別製
品の使用を中止し、廃棄するように指示した。
【第2報】
本事象の根本原因は、製造時に用いる特定のプリンタのIPアドレス
接続の問題により、作業中の製造用の印刷システムと別の製造ライ
ンの製造用の印刷システムの間で意図しない接続が生じ、本製品
の特定ロットで別製品の製品ラベルが混入したことである。措置対象
ロットについては、返送品等の調査により、本事象が確認されたロッ
トの製造時間と、IPアドレス接続の問題によりラベルの変更が発生し
た可能性のある製造時間について、製造時間及びカートン数が一
致することを確認したことから、1ロットに特定された。2023年よりラベ
培養同定 ・ 一般細 ル照合時にロット照合を可能にするためのアップグレードが実施さ
360
アメリカ
れ、これにより、本事象の発生を検出することができるようになった。
菌キット
なお、措置対象ロットの製造時にはこのアップグレードは有効でな
かったため、本事象が発生した。製造元は、各支社に、医療機関に
おいて措置対象ロット及び別製品の特定ロット製品を使用せず廃棄
する旨の情報提供を行うよう指示した。なお、本製品の措置対象ロッ
トは本邦に入荷しておらず、別製品については本邦での取扱いが
無いものである。
【第3報】
意図しないIPアドレスの接続の原因は関連するラインメンテナンス手
順書に、本事象が発生したカートナープリンターの交換方法と製造
現場での正しいIPアドレスの確立方法についての手順が文書化さ
れていなかったことである。再発防止策として、カートナープリンタの
設置および通信が正しいことの確認を含む新規の手順書を作成す
る予定である。
情報提供
対応不要
【第1報】
製造元で行われた当該製品使用における判定妨害の有無確認試
インスリン様成長因
験において、膣検体中の潤滑剤の存在が判定結果に干渉する可能
子結合蛋白1キット
性があり、使用説明書から逸脱していることが判明したため、加HC
腟分泌液中インスリ
は当該製品の全ロットがリコール(typeⅡ)されたことを公開した。
カナダ
361
ン様成長因子結合
【第2報】
蛋白1型(IGFBP-1)
リコール(typeⅡ)として、使用説明書が更新されるまでの間、顧客に
検出試薬
本情報を伝達するとともに、新しいキットにも情報提供文書を添付す
る。
情報提供
注目
No. 医薬品名(一般名) 措置概要
措置国
【第1報】
製造元において、当該製品を使用したHaemophilus influenzae およ
び Haemophilus parainfluenzaeの感受性測定結果にばらつきが認
められ、判定基準を満たさない可能性が判明した。調査の結果、製
造元は、当該製品の性能や品質に起因したものではなく、培地や菌
株などの複合的な要因により、検査結果にばらつきが生じている可
能性があると判断し、当該被検菌の薬剤感受性検査への当該製品
アメリカ、
薬剤感受性(一般細 の使用を中止するよう、顧客に対して情報提供することとした。
オーストラリ 情報提供
362
菌・ディスク法)キット 【第2報】
ア、カナダ
製造元において再現試験を実施したところ、所定の培地における当
該被検菌の増殖が悪く、阻止円の検出が困難であった。当該被検
菌以外の微生物に対しては、良好な性能を示すことが確認された。
なお、当該製品については出荷試験にて薬剤の力価を確認してい
る。製造元は、当該製品における薬剤感受性検査の被検菌から、当
該被検菌を除外することを決定し、顧客に対して情報提供することと
した。
対応中
海外製造元は、当該製品の特定ロット以降について、品質管理
(QC)および患者検体において、測定結果に負のバイアスが発生す
血液検査用免疫グ
363
る可能性を確認した。なお、2~8℃で冷蔵保存された未開封の試 欧州連合
ロブリンMキット
薬は影響を受けない。 海外製造元では現在原因の調査を行ってい
る。
対応中
56
情報提供