よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
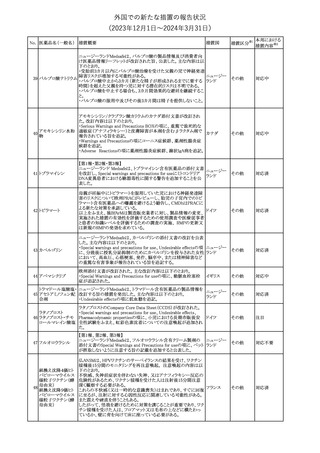
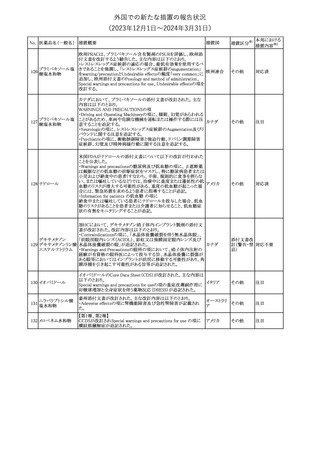
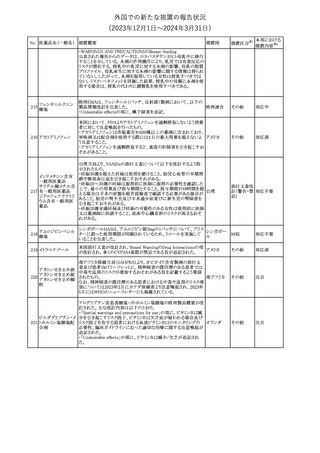
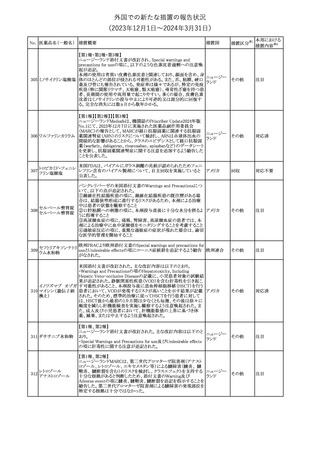
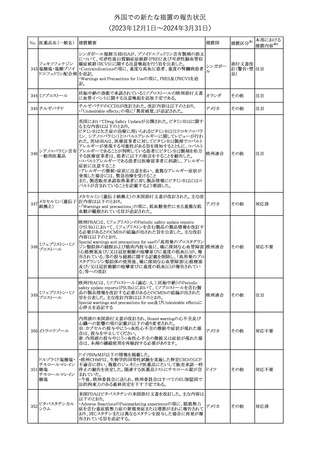
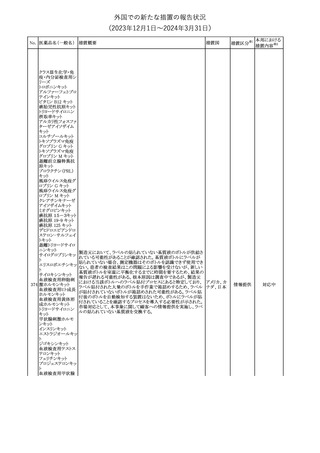
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
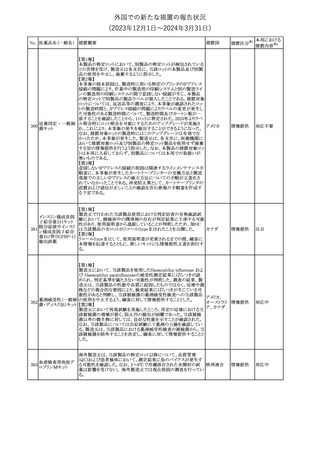
【第1報】【第2報】【第3報】
仏ANSMは、抗てんかん薬曝露による児の奇形及び神経発達障害
のリスクの程度に応じて抗てんかん薬を分類したシートを作成した。
報告書には以下の内容が含まれる。
バルプロ酸ナトリウム
29
・バルプロ酸:抗てんかん薬で最もリスク(奇形、神経発達障害)が高 フランス
プレガバリン
い。父親にバルプロ酸が投与された児における神経発達障害につ
いてはヨーロッパで評価中。
・プレガバリン:非曝露てんかん患者で観察された頻度と比較して、
最大1.5 倍の奇形リスクが確認されている。
その他
対応中
仏ANSMは、重篤な即時型アレルギー反応のリスクについて、以下
の内容の注意喚起文書を公表した。
・クロルヘキシジンに関連する重篤なアレルギー反応の報告数が増
加している。
フランス
・クロルヘキシジンは主に皮膚用又は口内洗浄用などの消毒剤とし
て多くの製品に含まれており、パッケージ又は説明書で組成を参照
することを推奨する。
その他
対応済
レボチロキシンナトリウムの企業中核データシートが改訂された。主
な改訂内容は以下のとおり。
レボチロキシンナトリ
31
・「Clinical particulars」の「Interaction with other medicinal products スイス
ウム水和物
and other forms of interaction」の項に、セマグルチドの併用によりレ
ボチロキシンのAUCが増加した旨が追記された。
その他
注目
CDSのSpecial Warnings and Precautions for Useの項に、市販後に
トファシチニブクエン
おいて本剤投与中のリウマチ患者において進行性多巣性白質脳症 アメリカ
酸塩
(PML)が1件報告された旨追記されたもの。
その他
対応済
米国添付文書の改訂情報を入手したもの。
ベンジルペニシリン Adverse Reactionsの項に、Immune System Disordersとして、心筋梗
33
アメリカ
ベンザチン水和物 塞を伴う又は伴わない急性心筋虚血がアレルギー反応の一部とし
て起こることがある(Kounis症候群)旨、追記された。
その他
注目
ニュージーランド添付文書が改訂された。主な改訂内容は以下のと
おり。
ニュージー
・Fertility, Pregnancy and Lactationの項に、男性において投与中及
その他
ランド
び投与終了後3カ月間は避妊を行うよう追記
・Undesirable Effectsの項に、脳浮腫及び肺水腫を追記
注目
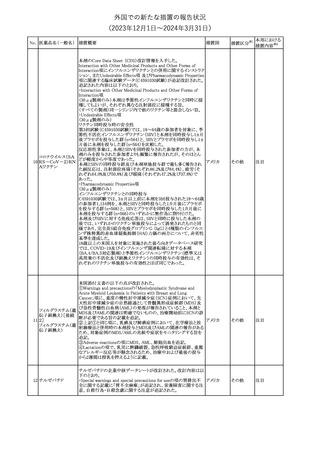
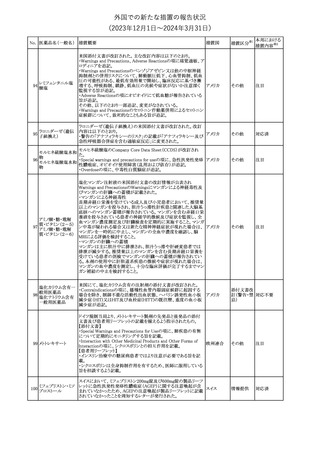
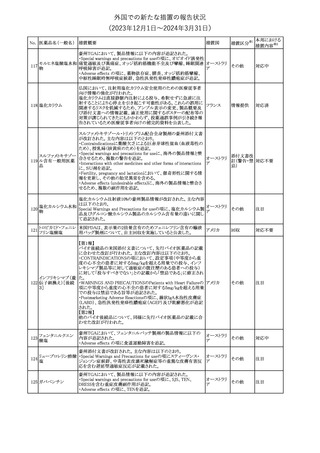
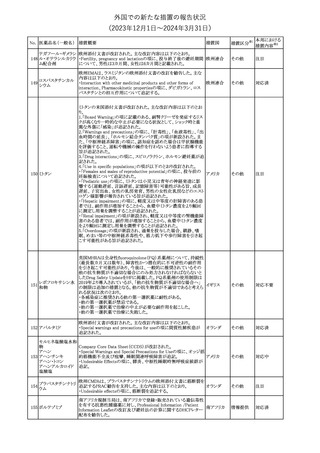
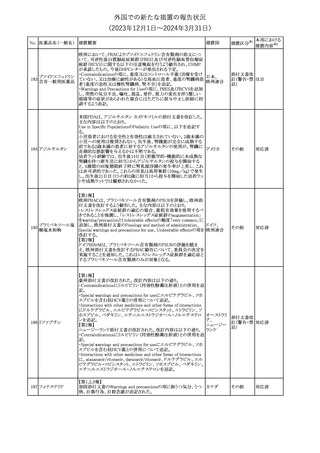
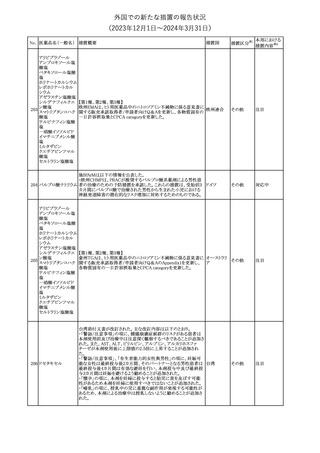
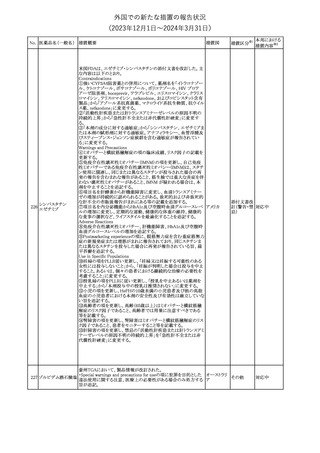
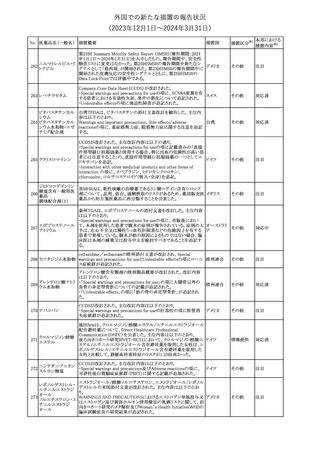
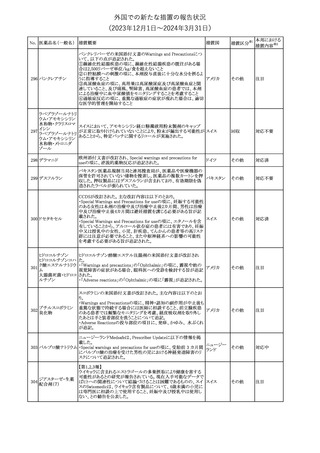
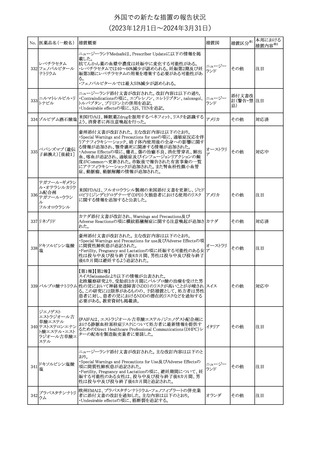
No. 医薬品名(一般名) 措置概要
クロルヘキシジング
ルコン酸塩
30 クロルヘキシジング
ルコン酸塩含有一
般用医薬品
32
34 メトトレキサート
措置国
インスリン グラルギン(遺伝子組換え)の米国添付文書が改訂され
インスリン グラルギ た。主な改訂内容は以下のとおり。
35 ン(遺伝子組換え) ・「Adverse reactions」の「Clinical trials experience」の項の臨床試験 アメリカ
[後続2]
の患者背景に関する記載に、患者の民族についての情報が追記さ
れた。
36
イバンドロン酸ナトリ 欧州PRACは、イバンドロン酸の製品概要に「大腿骨以外の長骨の
欧州連合
ウム水和物
非定型骨折」を追加することを公表した。
37 コルヒチン
【第1、2報】
仏国にてコルヒチンの外箱に新たな投与方法が記載された。記載内
容は以下のとおり。
・痛風の急性発作に対しては、1日目の負荷用量は1mg、1時間後に
0.5mgを投与し、2日目以降は0.5mgを1日2~3回投与する。
・慢性痛風患者における急性痛風発作の予防、特に尿酸降下治療 フランス
を開始する場合に対しては、腎障害、肝障害のない患者では1日
0.5~1mg、軽度から中等度の腎障害、肝障害のある患者では1日あ
たり0.5mgから開始する。
・副作用が発生し、中等度の腎機能障害がある場合は0.5mg隔日に
減らす。
【第1報】
Company Core Data Sheet(CCDS)に強膜炎が追記される予定であ
ブロルシズマブ(遺 る。
38
スイス
伝子組換え)
【第2報】
Company Core Data Sheet(CCDS)が改訂され、Adverse drug
reactionsの項に強膜炎が追記された。
6
その他
対応不要
その他
対応済
その他
注目
その他
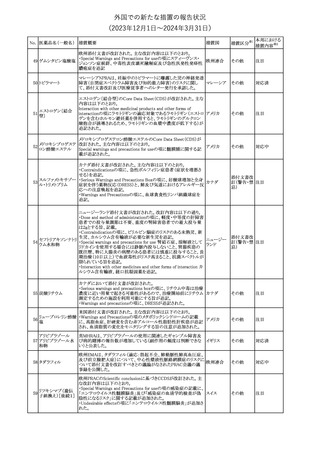
対応中
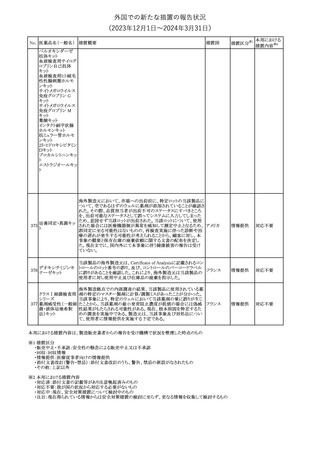
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
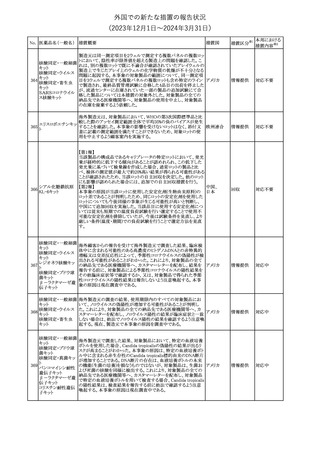
【第1報】【第2報】【第3報】
仏ANSMは、抗てんかん薬曝露による児の奇形及び神経発達障害
のリスクの程度に応じて抗てんかん薬を分類したシートを作成した。
報告書には以下の内容が含まれる。
バルプロ酸ナトリウム
29
・バルプロ酸:抗てんかん薬で最もリスク(奇形、神経発達障害)が高 フランス
プレガバリン
い。父親にバルプロ酸が投与された児における神経発達障害につ
いてはヨーロッパで評価中。
・プレガバリン:非曝露てんかん患者で観察された頻度と比較して、
最大1.5 倍の奇形リスクが確認されている。
その他
対応中
仏ANSMは、重篤な即時型アレルギー反応のリスクについて、以下
の内容の注意喚起文書を公表した。
・クロルヘキシジンに関連する重篤なアレルギー反応の報告数が増
加している。
フランス
・クロルヘキシジンは主に皮膚用又は口内洗浄用などの消毒剤とし
て多くの製品に含まれており、パッケージ又は説明書で組成を参照
することを推奨する。
その他
対応済
レボチロキシンナトリウムの企業中核データシートが改訂された。主
な改訂内容は以下のとおり。
レボチロキシンナトリ
31
・「Clinical particulars」の「Interaction with other medicinal products スイス
ウム水和物
and other forms of interaction」の項に、セマグルチドの併用によりレ
ボチロキシンのAUCが増加した旨が追記された。
その他
注目
CDSのSpecial Warnings and Precautions for Useの項に、市販後に
トファシチニブクエン
おいて本剤投与中のリウマチ患者において進行性多巣性白質脳症 アメリカ
酸塩
(PML)が1件報告された旨追記されたもの。
その他
対応済
米国添付文書の改訂情報を入手したもの。
ベンジルペニシリン Adverse Reactionsの項に、Immune System Disordersとして、心筋梗
33
アメリカ
ベンザチン水和物 塞を伴う又は伴わない急性心筋虚血がアレルギー反応の一部とし
て起こることがある(Kounis症候群)旨、追記された。
その他
注目
ニュージーランド添付文書が改訂された。主な改訂内容は以下のと
おり。
ニュージー
・Fertility, Pregnancy and Lactationの項に、男性において投与中及
その他
ランド
び投与終了後3カ月間は避妊を行うよう追記
・Undesirable Effectsの項に、脳浮腫及び肺水腫を追記
注目
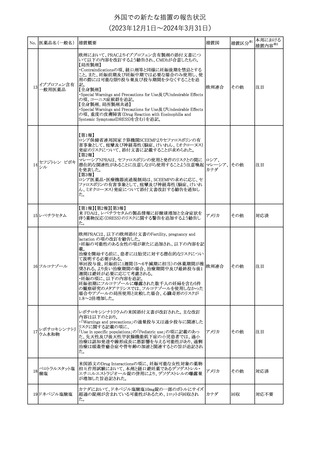
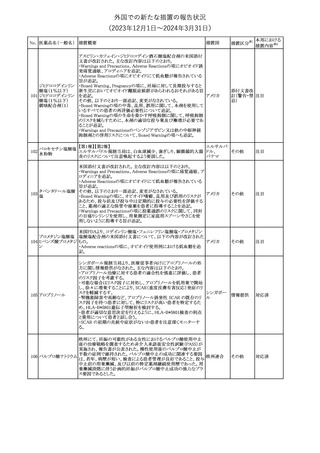
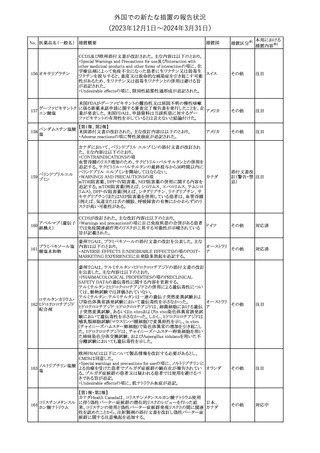
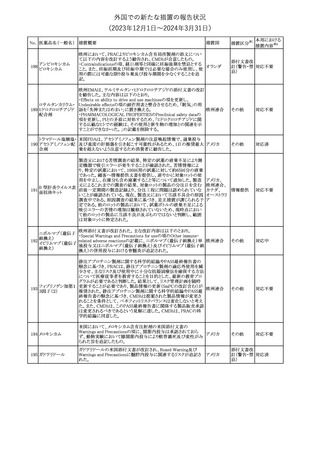
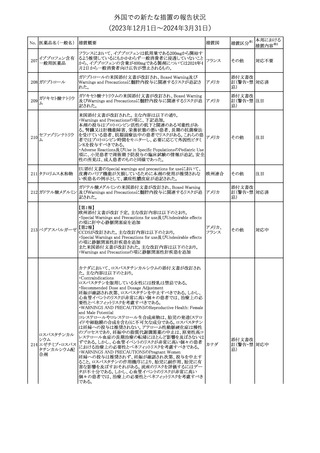
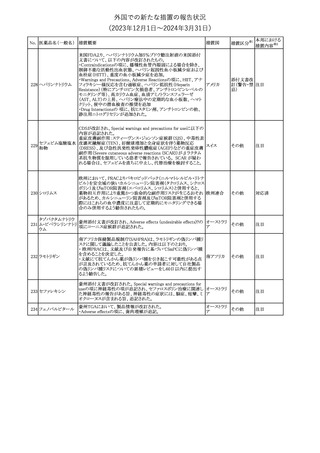
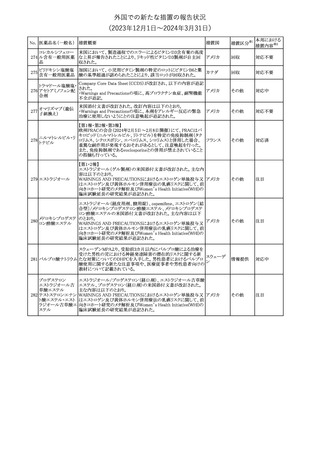
No. 医薬品名(一般名) 措置概要
クロルヘキシジング
ルコン酸塩
30 クロルヘキシジング
ルコン酸塩含有一
般用医薬品
32
34 メトトレキサート
措置国
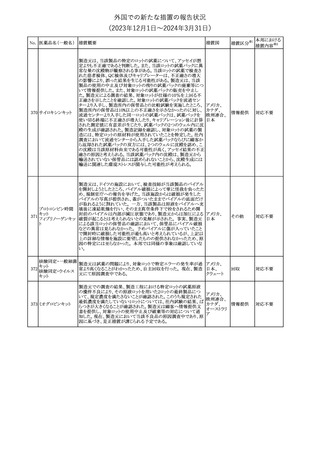
インスリン グラルギン(遺伝子組換え)の米国添付文書が改訂され
インスリン グラルギ た。主な改訂内容は以下のとおり。
35 ン(遺伝子組換え) ・「Adverse reactions」の「Clinical trials experience」の項の臨床試験 アメリカ
[後続2]
の患者背景に関する記載に、患者の民族についての情報が追記さ
れた。
36
イバンドロン酸ナトリ 欧州PRACは、イバンドロン酸の製品概要に「大腿骨以外の長骨の
欧州連合
ウム水和物
非定型骨折」を追加することを公表した。
37 コルヒチン
【第1、2報】
仏国にてコルヒチンの外箱に新たな投与方法が記載された。記載内
容は以下のとおり。
・痛風の急性発作に対しては、1日目の負荷用量は1mg、1時間後に
0.5mgを投与し、2日目以降は0.5mgを1日2~3回投与する。
・慢性痛風患者における急性痛風発作の予防、特に尿酸降下治療 フランス
を開始する場合に対しては、腎障害、肝障害のない患者では1日
0.5~1mg、軽度から中等度の腎障害、肝障害のある患者では1日あ
たり0.5mgから開始する。
・副作用が発生し、中等度の腎機能障害がある場合は0.5mg隔日に
減らす。
【第1報】
Company Core Data Sheet(CCDS)に強膜炎が追記される予定であ
ブロルシズマブ(遺 る。
38
スイス
伝子組換え)
【第2報】
Company Core Data Sheet(CCDS)が改訂され、Adverse drug
reactionsの項に強膜炎が追記された。
6
その他
対応不要
その他
対応済
その他
注目
その他
対応中