よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
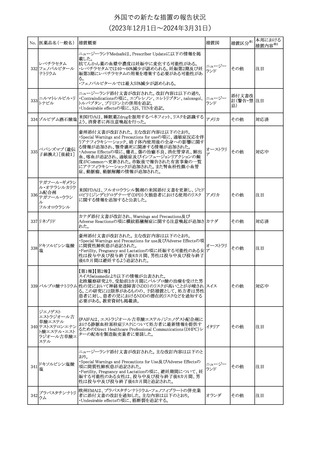
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
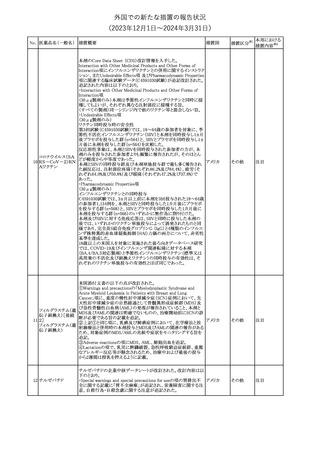
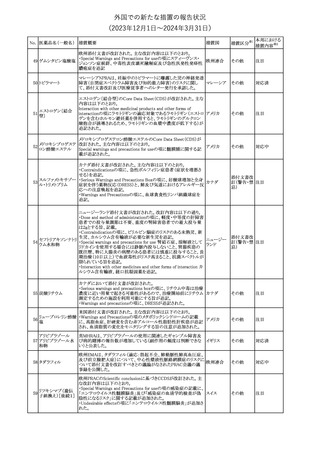
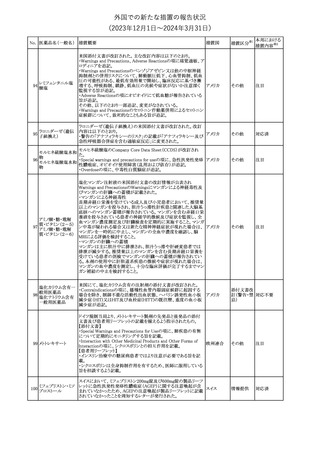
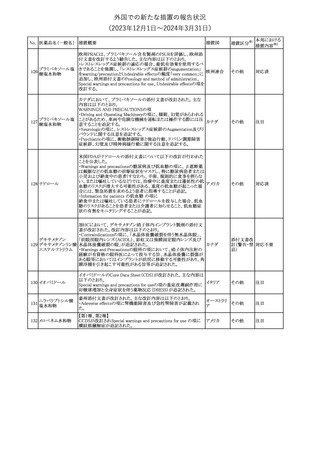
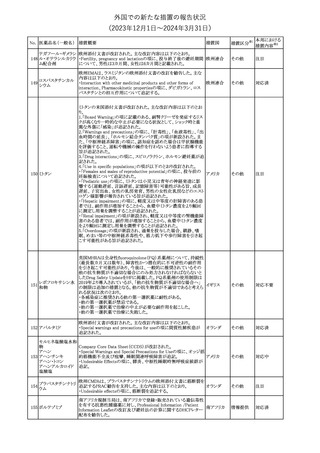
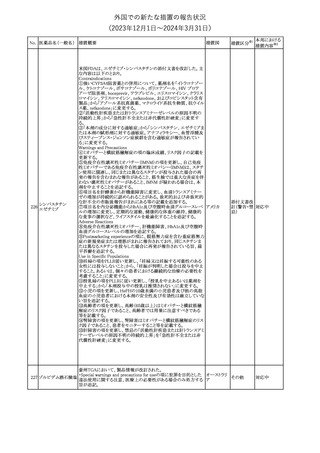
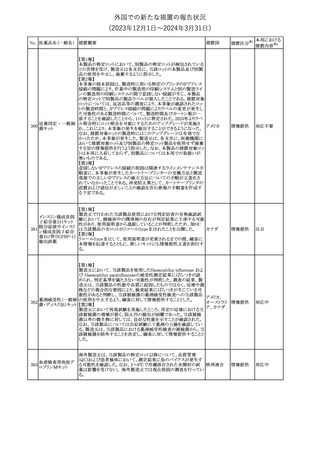
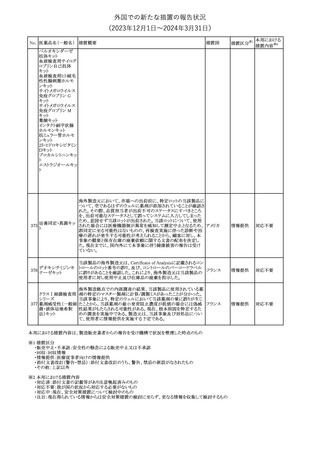
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
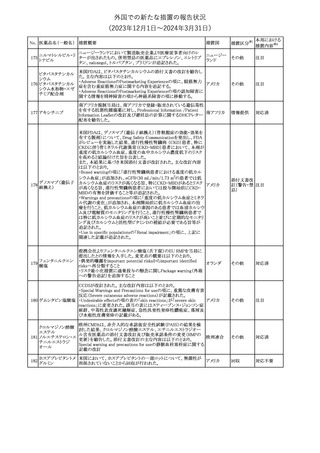
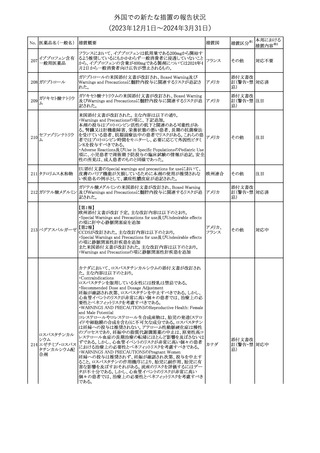
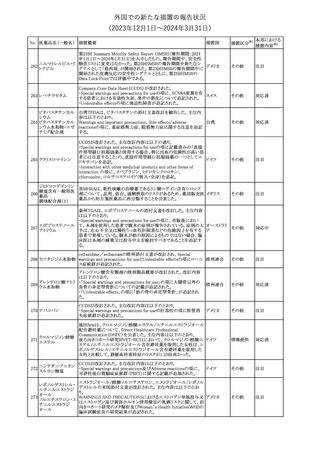
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Special warnings and precautions for useの項に、オピオイド誘発性
モルヒネ塩酸塩水和 痛覚過敏及び異痛症、オッジ括約筋機能不全及び攣縮、睡眠関連 オーストラリ
117
その他
ア
物
呼吸障害が追記。
・Adverse effects の項に、薬物依存症、膵炎、オッジ括約筋攣縮、
中枢性睡眠時無呼吸症候群、急性汎発性発疹性膿疱症が追記。
118 塩化カリウム
仏国において、注射用塩化カリウム安全使用のための医療従事者
向け情報の強化が行われた。
塩化カリウムは直接静脈内注射による投与、希釈せずに急速に注
射することにより心停止を引き起こす可能性がある。これらの誤用に
フランス
関連するリスクを低減するため、アンプル表示の変更、製品概要及
び添付文書への情報記載、適正使用に関するポスターの配布等の
対策が講じられてきたにもかかわらず、投薬過誤事例が引き続き報
告されているため医療従事者向けの補完的資料を公表した。
情報提供
本邦における
措置内容※2
対応中
対応済
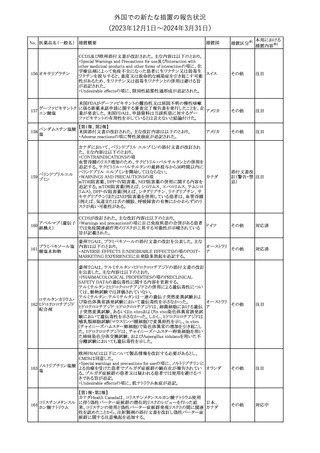
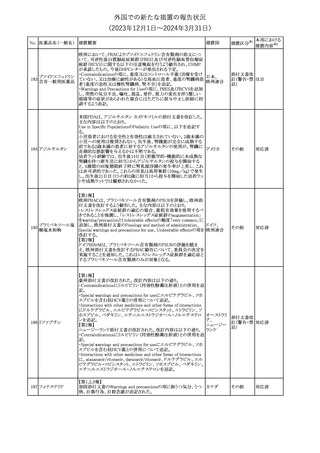
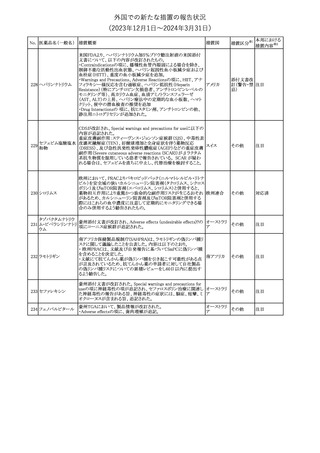
スルファメトキサゾール・トリメトプリム配合全身製剤の豪州添付文書
が改訂された。主な内容は以下のとおり。
・Contraindicationsに葉酸欠乏による巨赤芽球性貧血(血液毒性の
ため)、授乳婦(核黄疸のため)を追記。
・Special warnings and precautions for useに、海外の製品情報と整
スルファメトキサゾー
添付文書改
合させるため、複数の警告を追記。
オーストラリ
119 ル含有一般用医薬
訂(警告・禁 対応不要
・Interactions with other medicines and other forms of interactions ア
忌)
品
に、SU剤を追記。
・Fertility, pregnancy and lactationにおいて、催奇形性に関する情
報を更新し、その他の胎児異常を含める。
・Adverse effects (undesirable effects)に、海外の製品情報と整合さ
せるため、複数の副作用を追記。
塩化カルシウム注射液10%の豪州製品情報が改訂された。主な内容
は以下のとおり。
塩化カルシウム水和
オーストラリ
120
Special Warnings and Precautions for useの項に、塩化カルシウム製
その他
物
ア
品及びグルコン酸カルシウム製品のカルシウム含有量の違いに関し
て追記された。
121
トロピカミド・フェニレ 米国FDAは、表示量の2倍量含有のためフェニレフリン含有の輸液
アメリカ
フリン塩酸塩
用バッグ製剤について、自主回収を実施していると公表した。
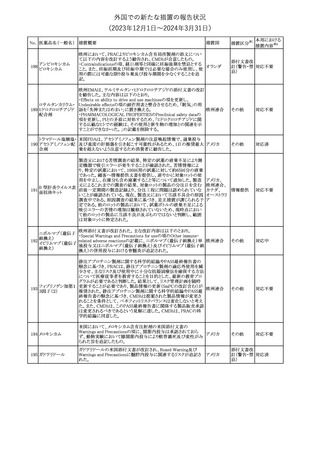
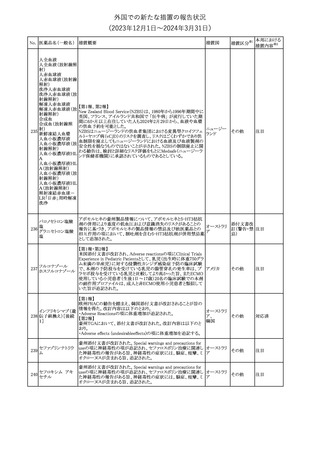
【第1報】
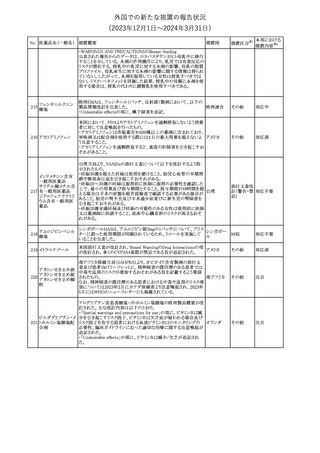
バイオ後続品の米国添付文書について、先行バイオ医薬品の記載
に合わせた改訂が行われた。主な改訂内容は以下のとおり。
・CONTRAINDICATIONSの項において、設定事項(中等度から重
度の心不全の患者に対する5mg/kgを超える用量での投与、インフ
レキシマブ製品等に対して過敏症の既往歴のある患者への投与)
に対して「投与すべきでない」との記載から「禁忌である」に修正され
インフリキシマブ(遺 た。
122 伝子組換え)[後続 ・WARNINGS AND PRECAUTIONSのPatients with Heart Failureの アメリカ
項に中等度から重度の心不全の患者に対する5mg/kgを超える用量
3]
での投与は禁忌である旨等が追記された。
・Postmarketing Adverse Reactionsの項に、線状IgA水泡性皮膚症
(LABD)、急性汎発性発疹性膿疱症(AGEP)及び乾癬悪化が追記
された。
【第2報】
他のバイオ後続品について、同様に先行バイオ医薬品の記載に合
わせた改訂が行われた。
123
フェンタニルクエン
酸塩
豪州TGAにおいて、フェンタニルパッチ製剤の製品情報に以下の
内容が追記された。
・Adverse effects の項に食道運動障害を追記。
注目
回収
対応不要
その他
注目
オーストラリ
その他
ア
対応中
豪州添付文書が改訂された。主な内容は以下のとおり。
リュープロレリン酢酸 ・Special Warnings and Precautions for useの項にスティーヴンス・ オーストラリ
その他
124
塩
ジョンソン症候群、中毒性表皮壊死融解症等の重篤な皮膚有害反 ア
応を含む遅延型過敏症反応が記載された。
注目
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Special warnings and precautions for useの項に、SJS、TEN、
DRESSを含む重症皮膚副作用が追記。
・Adverse effects の項に、TENを追記。
注目
125 ガバペンチン
23
オーストラリ
その他
ア
(2023年12⽉1⽇〜2024年3⽉31⽇)
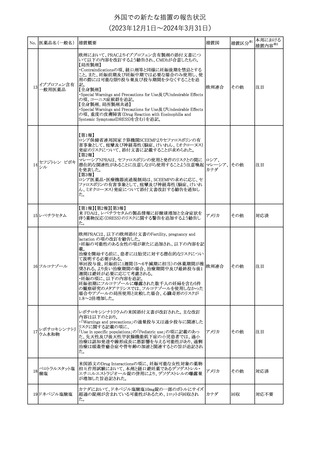
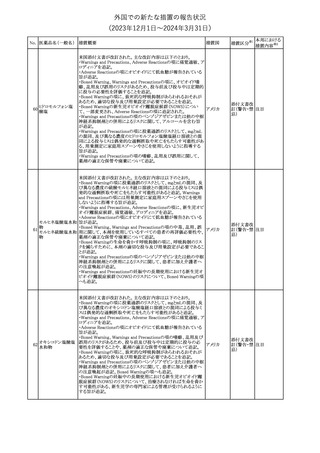
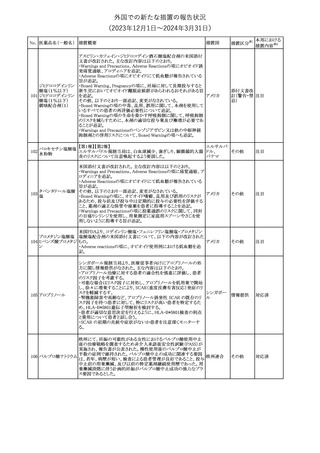
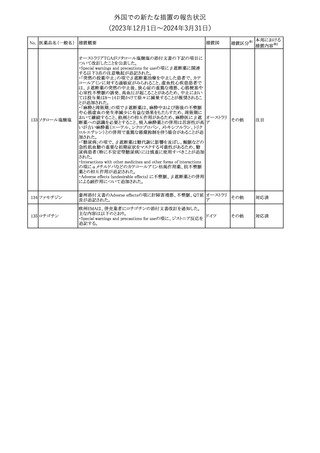
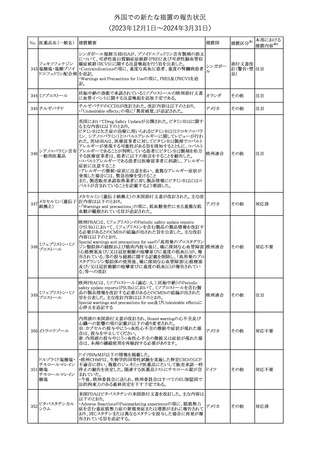
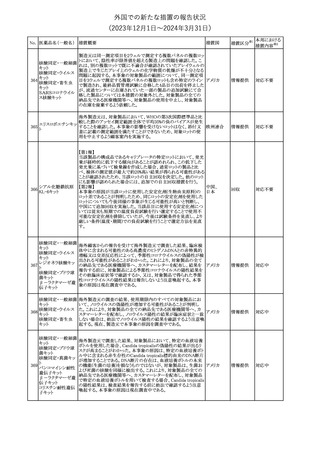
No. 医薬品名(一般名) 措置概要
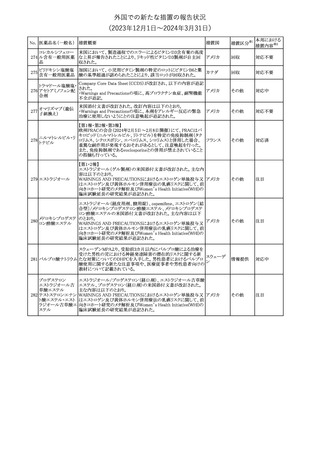
措置国
措置区分※1
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Special warnings and precautions for useの項に、オピオイド誘発性
モルヒネ塩酸塩水和 痛覚過敏及び異痛症、オッジ括約筋機能不全及び攣縮、睡眠関連 オーストラリ
117
その他
ア
物
呼吸障害が追記。
・Adverse effects の項に、薬物依存症、膵炎、オッジ括約筋攣縮、
中枢性睡眠時無呼吸症候群、急性汎発性発疹性膿疱症が追記。
118 塩化カリウム
仏国において、注射用塩化カリウム安全使用のための医療従事者
向け情報の強化が行われた。
塩化カリウムは直接静脈内注射による投与、希釈せずに急速に注
射することにより心停止を引き起こす可能性がある。これらの誤用に
フランス
関連するリスクを低減するため、アンプル表示の変更、製品概要及
び添付文書への情報記載、適正使用に関するポスターの配布等の
対策が講じられてきたにもかかわらず、投薬過誤事例が引き続き報
告されているため医療従事者向けの補完的資料を公表した。
情報提供
本邦における
措置内容※2
対応中
対応済
スルファメトキサゾール・トリメトプリム配合全身製剤の豪州添付文書
が改訂された。主な内容は以下のとおり。
・Contraindicationsに葉酸欠乏による巨赤芽球性貧血(血液毒性の
ため)、授乳婦(核黄疸のため)を追記。
・Special warnings and precautions for useに、海外の製品情報と整
スルファメトキサゾー
添付文書改
合させるため、複数の警告を追記。
オーストラリ
119 ル含有一般用医薬
訂(警告・禁 対応不要
・Interactions with other medicines and other forms of interactions ア
忌)
品
に、SU剤を追記。
・Fertility, pregnancy and lactationにおいて、催奇形性に関する情
報を更新し、その他の胎児異常を含める。
・Adverse effects (undesirable effects)に、海外の製品情報と整合さ
せるため、複数の副作用を追記。
塩化カルシウム注射液10%の豪州製品情報が改訂された。主な内容
は以下のとおり。
塩化カルシウム水和
オーストラリ
120
Special Warnings and Precautions for useの項に、塩化カルシウム製
その他
物
ア
品及びグルコン酸カルシウム製品のカルシウム含有量の違いに関し
て追記された。
121
トロピカミド・フェニレ 米国FDAは、表示量の2倍量含有のためフェニレフリン含有の輸液
アメリカ
フリン塩酸塩
用バッグ製剤について、自主回収を実施していると公表した。
【第1報】
バイオ後続品の米国添付文書について、先行バイオ医薬品の記載
に合わせた改訂が行われた。主な改訂内容は以下のとおり。
・CONTRAINDICATIONSの項において、設定事項(中等度から重
度の心不全の患者に対する5mg/kgを超える用量での投与、インフ
レキシマブ製品等に対して過敏症の既往歴のある患者への投与)
に対して「投与すべきでない」との記載から「禁忌である」に修正され
インフリキシマブ(遺 た。
122 伝子組換え)[後続 ・WARNINGS AND PRECAUTIONSのPatients with Heart Failureの アメリカ
項に中等度から重度の心不全の患者に対する5mg/kgを超える用量
3]
での投与は禁忌である旨等が追記された。
・Postmarketing Adverse Reactionsの項に、線状IgA水泡性皮膚症
(LABD)、急性汎発性発疹性膿疱症(AGEP)及び乾癬悪化が追記
された。
【第2報】
他のバイオ後続品について、同様に先行バイオ医薬品の記載に合
わせた改訂が行われた。
123
フェンタニルクエン
酸塩
豪州TGAにおいて、フェンタニルパッチ製剤の製品情報に以下の
内容が追記された。
・Adverse effects の項に食道運動障害を追記。
注目
回収
対応不要
その他
注目
オーストラリ
その他
ア
対応中
豪州添付文書が改訂された。主な内容は以下のとおり。
リュープロレリン酢酸 ・Special Warnings and Precautions for useの項にスティーヴンス・ オーストラリ
その他
124
塩
ジョンソン症候群、中毒性表皮壊死融解症等の重篤な皮膚有害反 ア
応を含む遅延型過敏症反応が記載された。
注目
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Special warnings and precautions for useの項に、SJS、TEN、
DRESSを含む重症皮膚副作用が追記。
・Adverse effects の項に、TENを追記。
注目
125 ガバペンチン
23
オーストラリ
その他
ア