よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
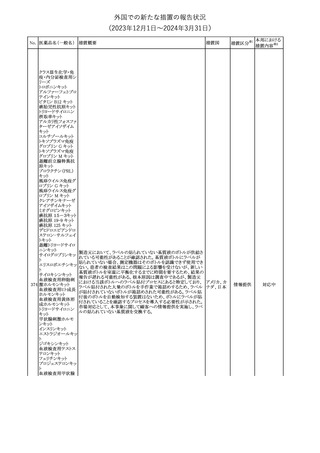
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
テガフール・ギメラシ 欧州添付文書が改訂された。主な改訂内容は以下のとおり。
148 ル・オテラシルカリウ ・Fertility, pregnancy and lactationの項に、投与終了後の避妊期間 欧州連合
ム配合剤
について、男性は3カ月間、女性は6カ月間と記載された。
その他
注目
欧州EMAは、ラスミジタンの欧州添付文書の改訂を勧告した。主な
内容は以下のとおり。
ロスバスタチンカル
149
・Interaction with other medicinal products and other forms of
欧州連合
シウム
interaction、Pharmacokinetic propertiesの項に、ダビガトラン、ロス
バスタチンとの相互作用について追記する。
その他
対応済
ミトタンの米国添付文書が改訂された。主な改訂内容は以下のとお
り。
1.「Boxed Warning」の項に記載のある、副腎クリーゼを発症するリス
クが高くなり一時的な中止が必要になる状況として、ショック時と重
篤な外傷に「感染」が追記された。
2.「Warnings and precautions」の項に、「肝毒性」、「血液毒性」、「出
血時間の延長」、「ホルモン結合タンパク質」の項が新設された。ま
た、「中枢神経系障害」の項に、認知症を認めた場合は甲状腺機能
を評価すること、運転や機械の操作を行わないよう患者に指導する
旨が追記された。
3.「Drug interactions」の項に、スピロノラクトン、ホルモン避妊薬が追
記された。
4.「Use in specific populations」の項が以下のとおり改訂された。
・「Females and males of reproductive potential」の項に、投与前の
アメリカ
妊娠検査について追記された。
・「Pediatric use」の項に、ミトタンは小児又は青年の神経発達に影
響する(運動遅延、言語遅延、記憶障害等)可能性がある旨、成長
遅延、子宮出血、女性の乳房発育、男性の女性化乳房などのエスト
ロゲン様影響が報告されている旨が追記された。
・「Hepatic impairment」の項に、軽度又は中等度の肝障害のある患
者では、副作用が増加することから、血漿中ミトタン濃度をより頻回
に測定し用量を調整することが追記された。
・「Renal impairment」の項が新設され、軽度又は中等度の腎機能障
害のある患者では、副作用が増加することから、血漿中ミトタン濃度
をより頻回に測定し用量を調整することが追記された。
5.「Overdosage」の項が新設され、過量を投与した場合、鎮静、嗜
眠、めまい等の中枢神経系毒性や、筋力低下や歩行障害を引き起
こす可能性がある旨が追記された。
その他
注目
英国MHRAは全身性fluoroquinolone(FQ)系薬剤について、持続性
(最長数カ月又は数年)、障害性かつ潜在的に不可逆性の副作用
を引き起こす可能性があり、今後は、一般的に推奨されているその
他の抗生物質が不適切な場合にのみ処方されなければならないと
したDrug Safety UpdateをHPに掲載した。FQ系薬剤の使用制限は
レボフロキサシン水 2019年より導入されているが、「他の抗生物質が不適切な場合へ」
イギリス
151
和物
の制限は追加の措置となる。他の抗生物質が不適切であると考えら
れる状況は次のとおり。
・各感染症に推奨される他の第一選択薬に耐性がある。
・他の第一選択薬が禁忌である。
・他の第一選択薬で治療の中止が必要な副作用を起こした。
・他の第一選択薬で治療に失敗した。
その他
対応不要
オランダ
その他
対応済
モルヒネ塩酸塩水和
物
Company Core Data Sheet(CCDS)が改訂された。
アヘン
・Special Warnings and Special Precautions for Useの項に、オッジ括
約筋機能不全及び痙攣、睡眠関連呼吸障害が追記。
アメリカ
153 アヘンチンキ
アヘン・トコン
・Undesirable Effectsの項に、膵炎、中枢性睡眠時無呼吸症候群が
アヘンアルカロイド 追記。
塩酸塩
その他
対応中
欧州CMDhは、プラバスタチンナトリウムの欧州添付文書に筋断裂を
プラバスタチンナトリ
追記するPRAC勧告を支持した。主な内容は以下のとおり。
オランダ
ウム
・Undesirable effectsの項に、筋断裂を追記する。
その他
注目
情報提供
対応済
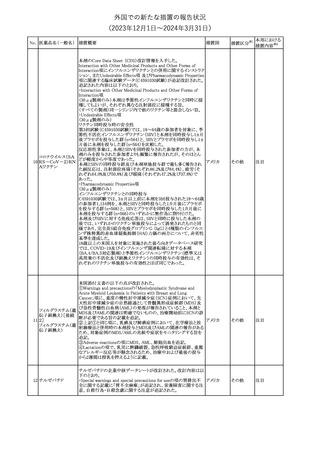
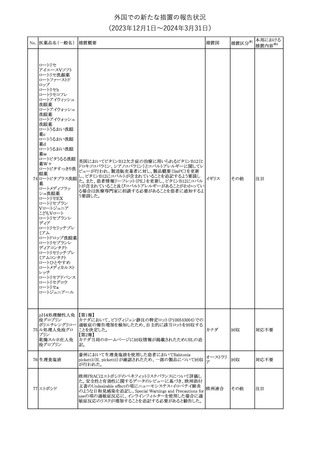
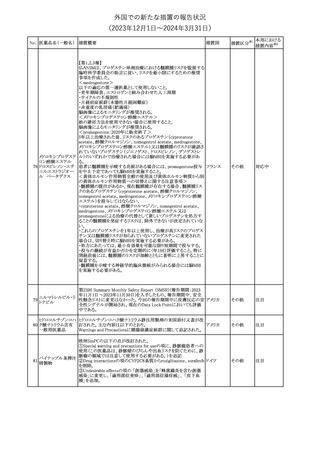
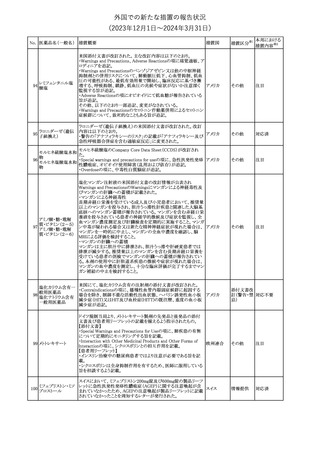
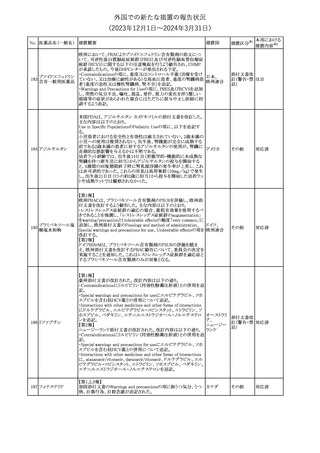
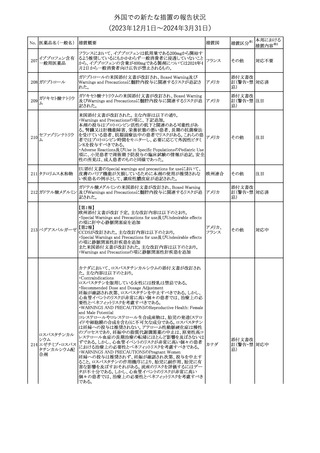
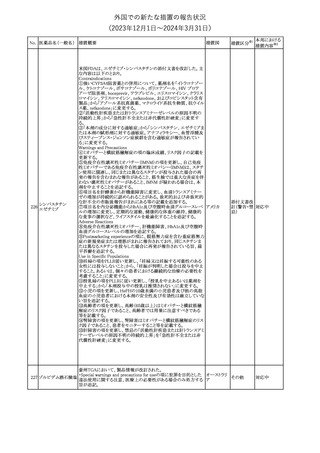
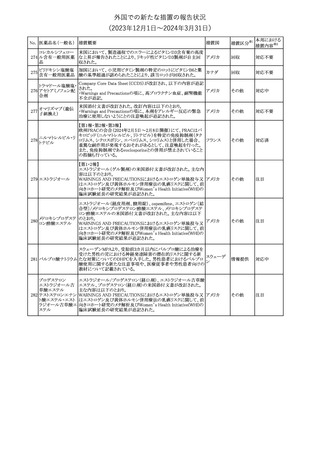
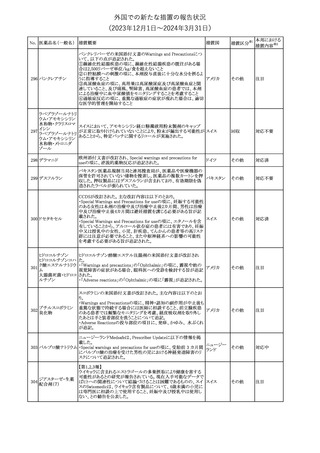
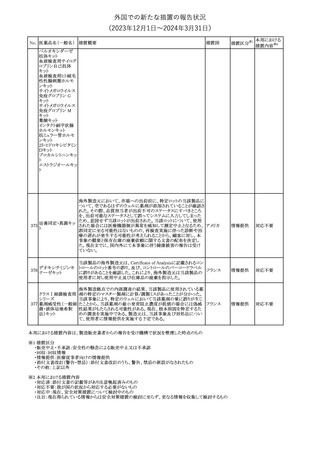
No. 医薬品名(一般名) 措置概要
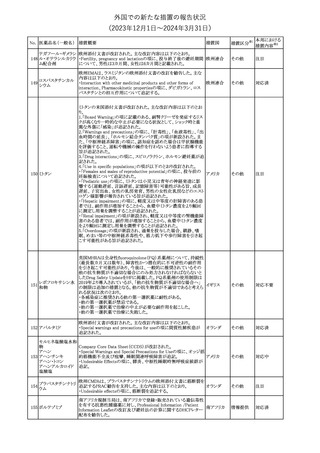
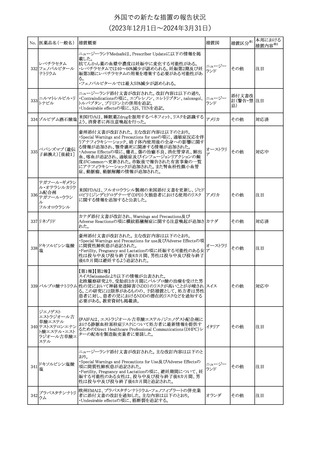
150 ミトタン
152 アパルタミド
154
155 ボルテゾミブ
措置国
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
・Special warnings and precautions for useの項に間質性肺疾患が
追記された。
南アフリカ規制当局は、南アフリカで登録・販売されている遺伝毒性
を有する抗悪性腫瘍薬に対し、Professional Information /Patient
南アフリカ
Information Leafletの改訂及び避妊法の計算に関するDHCPレター
配布を勧告した。
28
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
テガフール・ギメラシ 欧州添付文書が改訂された。主な改訂内容は以下のとおり。
148 ル・オテラシルカリウ ・Fertility, pregnancy and lactationの項に、投与終了後の避妊期間 欧州連合
ム配合剤
について、男性は3カ月間、女性は6カ月間と記載された。
その他
注目
欧州EMAは、ラスミジタンの欧州添付文書の改訂を勧告した。主な
内容は以下のとおり。
ロスバスタチンカル
149
・Interaction with other medicinal products and other forms of
欧州連合
シウム
interaction、Pharmacokinetic propertiesの項に、ダビガトラン、ロス
バスタチンとの相互作用について追記する。
その他
対応済
ミトタンの米国添付文書が改訂された。主な改訂内容は以下のとお
り。
1.「Boxed Warning」の項に記載のある、副腎クリーゼを発症するリス
クが高くなり一時的な中止が必要になる状況として、ショック時と重
篤な外傷に「感染」が追記された。
2.「Warnings and precautions」の項に、「肝毒性」、「血液毒性」、「出
血時間の延長」、「ホルモン結合タンパク質」の項が新設された。ま
た、「中枢神経系障害」の項に、認知症を認めた場合は甲状腺機能
を評価すること、運転や機械の操作を行わないよう患者に指導する
旨が追記された。
3.「Drug interactions」の項に、スピロノラクトン、ホルモン避妊薬が追
記された。
4.「Use in specific populations」の項が以下のとおり改訂された。
・「Females and males of reproductive potential」の項に、投与前の
アメリカ
妊娠検査について追記された。
・「Pediatric use」の項に、ミトタンは小児又は青年の神経発達に影
響する(運動遅延、言語遅延、記憶障害等)可能性がある旨、成長
遅延、子宮出血、女性の乳房発育、男性の女性化乳房などのエスト
ロゲン様影響が報告されている旨が追記された。
・「Hepatic impairment」の項に、軽度又は中等度の肝障害のある患
者では、副作用が増加することから、血漿中ミトタン濃度をより頻回
に測定し用量を調整することが追記された。
・「Renal impairment」の項が新設され、軽度又は中等度の腎機能障
害のある患者では、副作用が増加することから、血漿中ミトタン濃度
をより頻回に測定し用量を調整することが追記された。
5.「Overdosage」の項が新設され、過量を投与した場合、鎮静、嗜
眠、めまい等の中枢神経系毒性や、筋力低下や歩行障害を引き起
こす可能性がある旨が追記された。
その他
注目
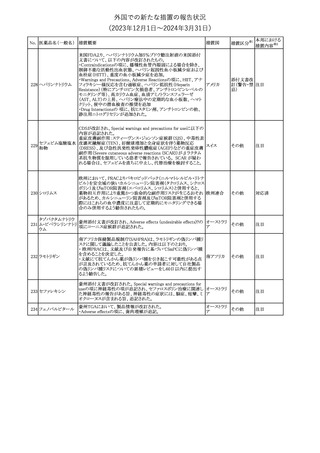
英国MHRAは全身性fluoroquinolone(FQ)系薬剤について、持続性
(最長数カ月又は数年)、障害性かつ潜在的に不可逆性の副作用
を引き起こす可能性があり、今後は、一般的に推奨されているその
他の抗生物質が不適切な場合にのみ処方されなければならないと
したDrug Safety UpdateをHPに掲載した。FQ系薬剤の使用制限は
レボフロキサシン水 2019年より導入されているが、「他の抗生物質が不適切な場合へ」
イギリス
151
和物
の制限は追加の措置となる。他の抗生物質が不適切であると考えら
れる状況は次のとおり。
・各感染症に推奨される他の第一選択薬に耐性がある。
・他の第一選択薬が禁忌である。
・他の第一選択薬で治療の中止が必要な副作用を起こした。
・他の第一選択薬で治療に失敗した。
その他
対応不要
オランダ
その他
対応済
モルヒネ塩酸塩水和
物
Company Core Data Sheet(CCDS)が改訂された。
アヘン
・Special Warnings and Special Precautions for Useの項に、オッジ括
約筋機能不全及び痙攣、睡眠関連呼吸障害が追記。
アメリカ
153 アヘンチンキ
アヘン・トコン
・Undesirable Effectsの項に、膵炎、中枢性睡眠時無呼吸症候群が
アヘンアルカロイド 追記。
塩酸塩
その他
対応中
欧州CMDhは、プラバスタチンナトリウムの欧州添付文書に筋断裂を
プラバスタチンナトリ
追記するPRAC勧告を支持した。主な内容は以下のとおり。
オランダ
ウム
・Undesirable effectsの項に、筋断裂を追記する。
その他
注目
情報提供
対応済
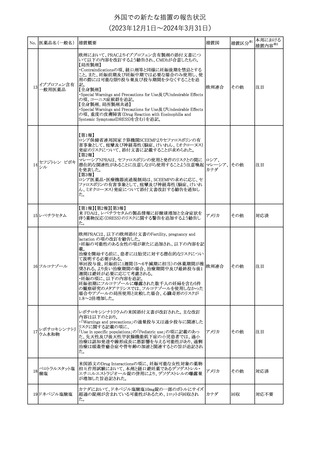
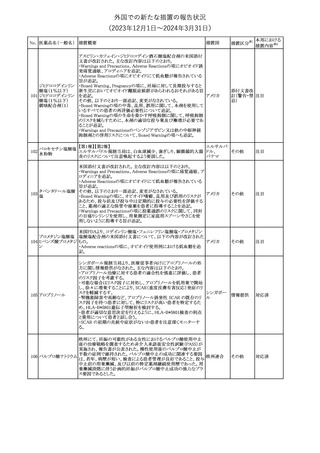
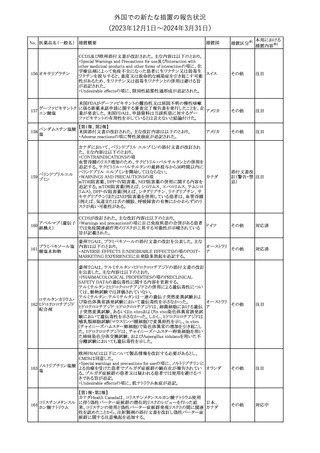
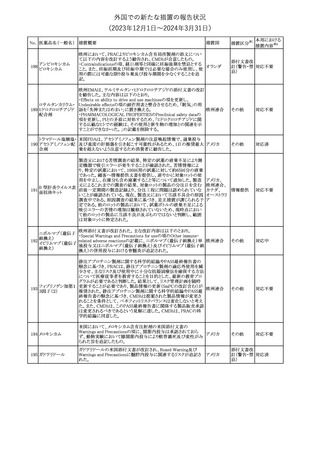
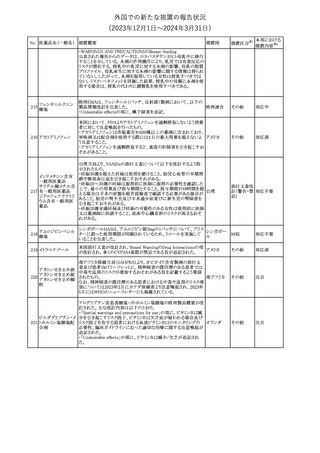
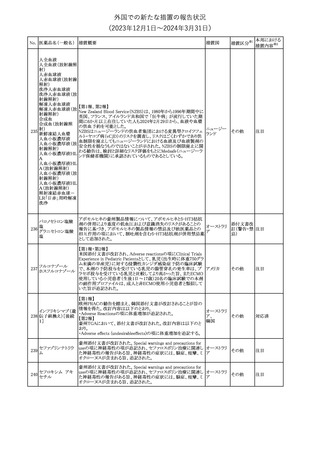
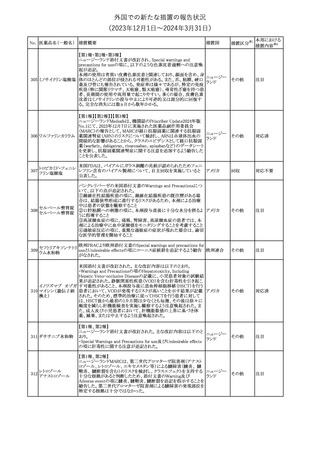
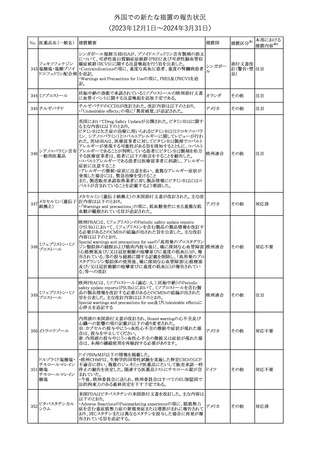
No. 医薬品名(一般名) 措置概要
150 ミトタン
152 アパルタミド
154
155 ボルテゾミブ
措置国
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
・Special warnings and precautions for useの項に間質性肺疾患が
追記された。
南アフリカ規制当局は、南アフリカで登録・販売されている遺伝毒性
を有する抗悪性腫瘍薬に対し、Professional Information /Patient
南アフリカ
Information Leafletの改訂及び避妊法の計算に関するDHCPレター
配布を勧告した。
28