よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (54 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
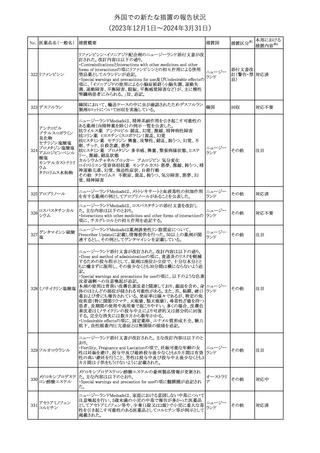
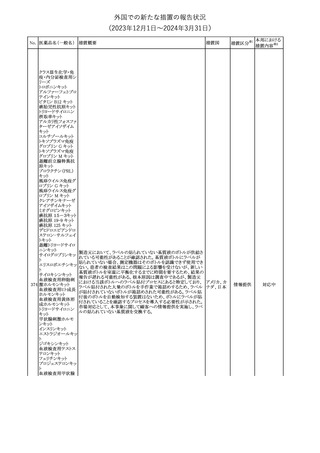
外国での新たな措置の報告状況
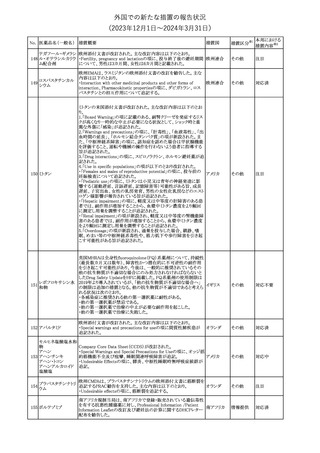
(2023年12⽉1⽇〜2024年3⽉31⽇)
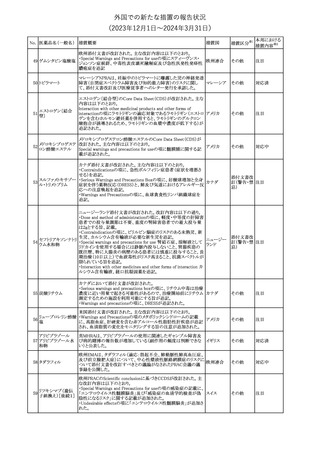
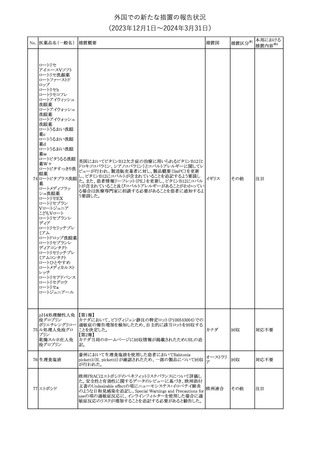
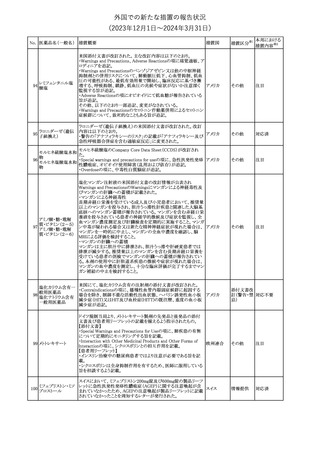
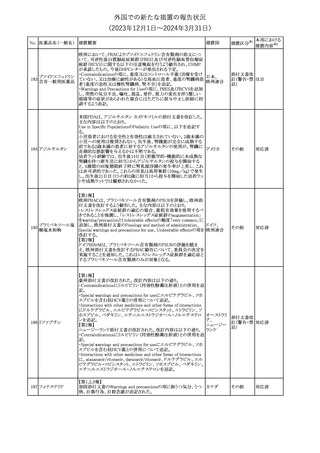
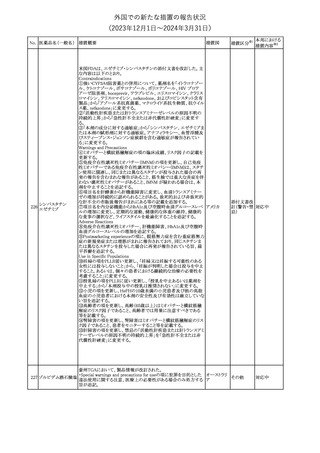
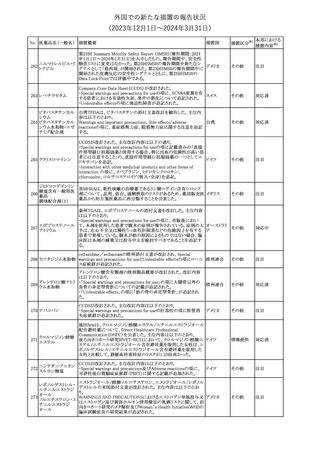
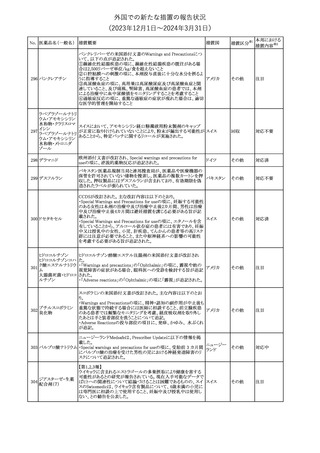
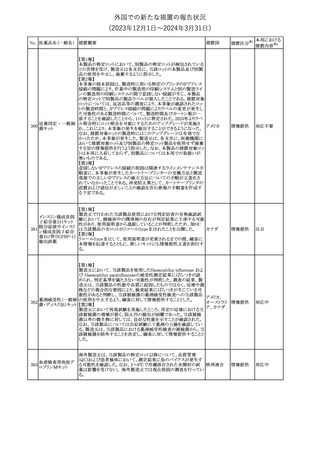
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
シンガポール規制当局HSAが、プソイドエフェドリン含有製剤の添文
について、可逆性後白質脳症症候群(PRES)及び可逆性脳血管収
フェキソフェナジン 縮症候群(RCVS)に関する注意喚起を行う旨を公表した。
添付文書改
シンガポー
343 塩酸塩・塩酸プソイ ・Contraindicationsの項に、重度な高血圧患者、重度の腎臓病患者
訂(警告・禁 注目
ル
ドエフェドリン配合剤 を追記。
忌)
・Warnings and Precautions for Useの項に、PRES及びRCVSを追
記。
344 ミソプロストール
妊娠中絶の効能で承認されているミソプロストールの欧州添付文書
オランダ
に血管イベントに関する注意喚起を追加予定である。
その他
注目
345 チルゼパチド
チルゼパチドのCCDSが改訂された。改訂内容は以下のとおり。
・「Undesirable effects」の項に「異常感覚」が追記された。
その他
注目
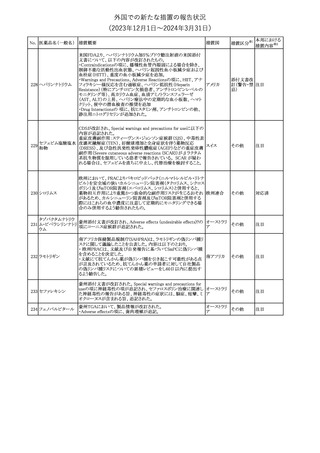
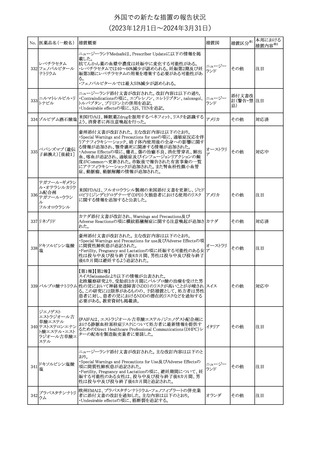
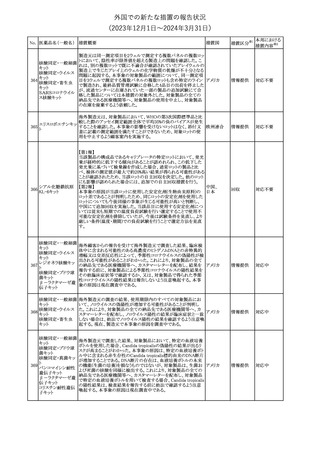
英国においてDrug Safety Updateが公開された。ビタミンB12に関す
る主な内容は以下のとおり。
ビタミンB12欠乏症の治療に用いられるビタミンB12(ヒドロキソコバラ
ミン、シアノコバラミン)とコバルトアレルギーに関してレビューが行わ
れた。英MHRAは、医療従事者に対してビタミンB12製剤でコバルト
アレルギーが発現する可能性がある旨を周知するとともに、コバルト
シアノコバラミン含有 アレルギーであることが判明している患者にビタミンB12製剤を処方
欧州連合
346
一般用医薬品
する医療従事者は、患者に以下の助言をすることを勧告した。
・コバルトアレルギーである患者は医療従事者に相談し、アレルギー
症状に注意すること
・アレルギーの徴候・症状に注意を払い、重篤なアレルギー症状が
発現した場合には、緊急治療を受けること
また、製造販売承認取得業者に対し製品情報にビタミンB12にはコ
バルトが含まれていることを記載するよう要請した。
その他
注目
メカセルミン(遺伝子組換え)の米国添付文書が改訂された。主な改
メカセルミン(遺伝子 訂内容は以下のとおり。
アメリカ
組換え)
・「Warnings and precautions」の項に、低血糖発作に至る重篤な低
血糖が観察されている旨が追記された。
その他
対応済
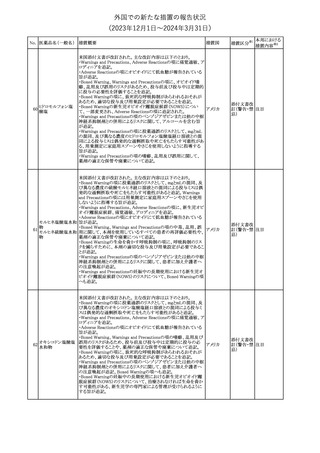
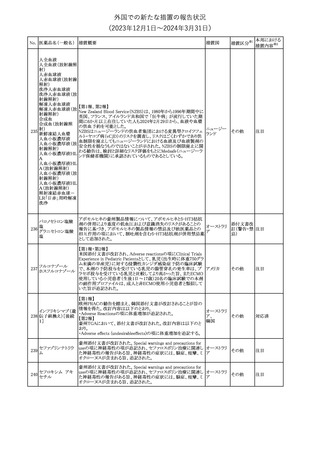
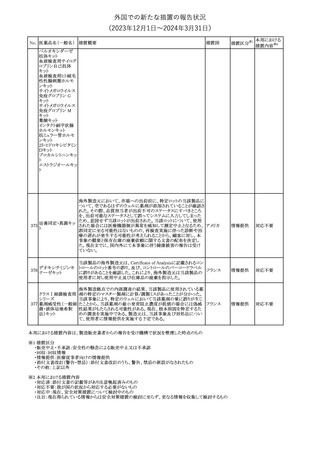
欧州PRACは、ミフェプリストンのPeriodic safety update reports
(PSURs)において、ミフェプリストンを含む製品の製品情報を改訂す
る必要があるとのCMDhの結論が出された旨を公表した。主な改訂
内容は以下のとおり。
Special warnings and precautions for useの「高用量のプロスタグラン
ミフェプリストン・ミソ
348
ジン類似体の経腟および筋肉内投与後に、稀に深刻な心血管障害 欧州連合
プロストール
(心筋梗塞及び/又は冠状動脈の痙攣並びに重度の低血圧)が、報
告されている」等の投与経路に関する記載を削除し、「高用量のプロ
スタグランジン類似体の使用後、稀に深刻な心血管障害(心筋梗塞
及び/又は冠状動脈の痙攣並びに重度の低血圧)が報告されてい
る」等への改訂
その他
対応不要
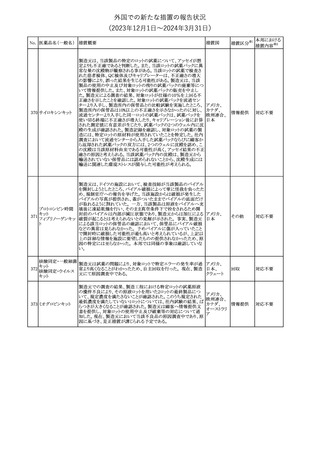
欧州PRACは、ミソプロストール(適応:人工妊娠中絶)のPeriodic
safety update reports(PSURs)において、ミソプロストールを含む製
ミフェプリストン・ミソ 品の製品情報を改訂する必要があるとのCMDhの結論が出された
349
欧州連合
プロストール
旨を公表した。主な改訂内容は以下のとおり。
Special warnings and precautions for use及びUndesirable effectsに
心停止を追記する
その他
注目
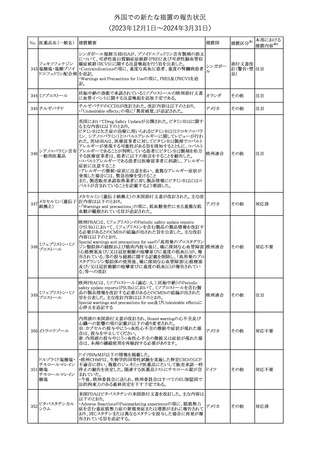
350 イトラコナゾール
内用液の米国添付文書が改訂され、Boxed warningの心不全及び
心臓への影響の項の記載が以下の通り変更された。
旧:カプセルの投与中にうっ血性心不全の徴候や症状が現れた場
アメリカ
合は、投与を中止してください。
新:内用液の投与中にうっ血性心不全の徴候又は症状が現れた場
合は、本剤の継続使用を再検討する必要があります。
その他
対応不要
ドルゾラミド塩酸塩・
チモロールマレイン
351 酸塩
チモロールマレイン
酸塩
ドイツBfArMが以下の情報を掲載した。
・欧州CHMPは、生物学的同等性試験を実施した特定CROのGCP
不適合に伴い、複数のジェネリック医薬品にたいして販売承認一時
停止の勧告を決定した。関連する医薬品リストにチモロール錠が含 ドイツ
まれていた。
・今後、欧州委員会に送られ、欧州委員会はすべてのEU加盟国で
法的拘束力のある最終決定を下す予定である。
その他
対応不要
その他
対応済
347
アメリカ
米国FDAはピタバスタチンの米国添付文書を改訂した。主な内容は
以下のとおり。
ピタバスタチンカル ・Adverse ReactionsのPostmarketing experienceの項に、眼筋無力
352
アメリカ
シウム
症を含む重症筋無力症の新規発症または増悪がまれに報告されて
おり、同じスタチンまたは異なるスタチンを投与した場合に再発が報
告されている旨を追記する。
54
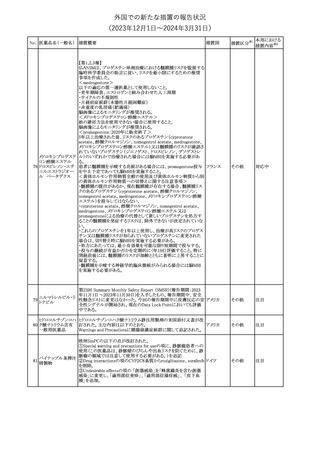
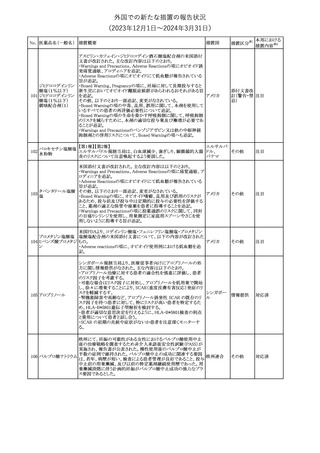
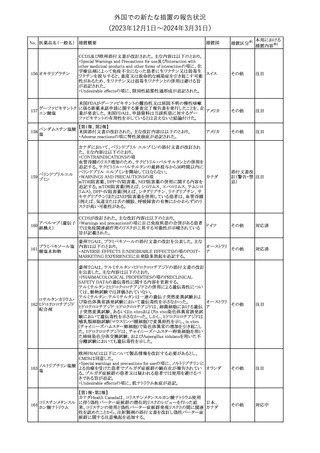
(2023年12⽉1⽇〜2024年3⽉31⽇)
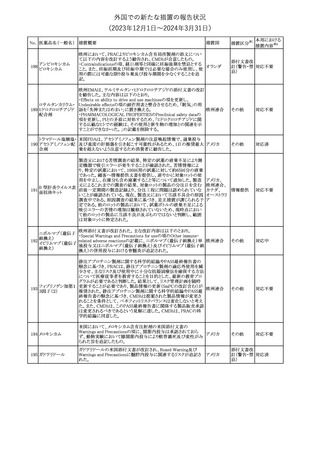
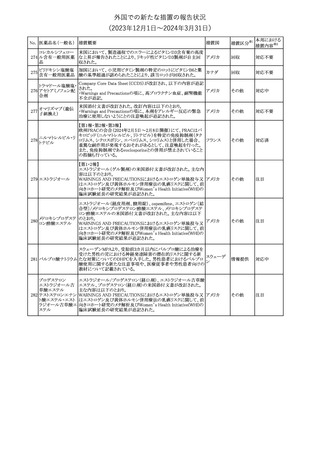
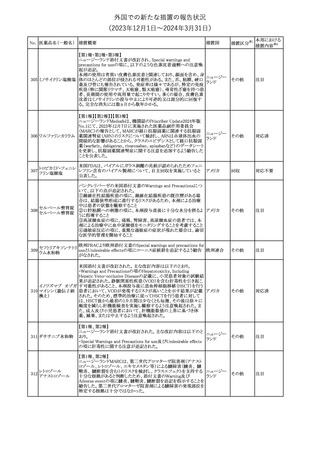
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
シンガポール規制当局HSAが、プソイドエフェドリン含有製剤の添文
について、可逆性後白質脳症症候群(PRES)及び可逆性脳血管収
フェキソフェナジン 縮症候群(RCVS)に関する注意喚起を行う旨を公表した。
添付文書改
シンガポー
343 塩酸塩・塩酸プソイ ・Contraindicationsの項に、重度な高血圧患者、重度の腎臓病患者
訂(警告・禁 注目
ル
ドエフェドリン配合剤 を追記。
忌)
・Warnings and Precautions for Useの項に、PRES及びRCVSを追
記。
344 ミソプロストール
妊娠中絶の効能で承認されているミソプロストールの欧州添付文書
オランダ
に血管イベントに関する注意喚起を追加予定である。
その他
注目
345 チルゼパチド
チルゼパチドのCCDSが改訂された。改訂内容は以下のとおり。
・「Undesirable effects」の項に「異常感覚」が追記された。
その他
注目
英国においてDrug Safety Updateが公開された。ビタミンB12に関す
る主な内容は以下のとおり。
ビタミンB12欠乏症の治療に用いられるビタミンB12(ヒドロキソコバラ
ミン、シアノコバラミン)とコバルトアレルギーに関してレビューが行わ
れた。英MHRAは、医療従事者に対してビタミンB12製剤でコバルト
アレルギーが発現する可能性がある旨を周知するとともに、コバルト
シアノコバラミン含有 アレルギーであることが判明している患者にビタミンB12製剤を処方
欧州連合
346
一般用医薬品
する医療従事者は、患者に以下の助言をすることを勧告した。
・コバルトアレルギーである患者は医療従事者に相談し、アレルギー
症状に注意すること
・アレルギーの徴候・症状に注意を払い、重篤なアレルギー症状が
発現した場合には、緊急治療を受けること
また、製造販売承認取得業者に対し製品情報にビタミンB12にはコ
バルトが含まれていることを記載するよう要請した。
その他
注目
メカセルミン(遺伝子組換え)の米国添付文書が改訂された。主な改
メカセルミン(遺伝子 訂内容は以下のとおり。
アメリカ
組換え)
・「Warnings and precautions」の項に、低血糖発作に至る重篤な低
血糖が観察されている旨が追記された。
その他
対応済
欧州PRACは、ミフェプリストンのPeriodic safety update reports
(PSURs)において、ミフェプリストンを含む製品の製品情報を改訂す
る必要があるとのCMDhの結論が出された旨を公表した。主な改訂
内容は以下のとおり。
Special warnings and precautions for useの「高用量のプロスタグラン
ミフェプリストン・ミソ
348
ジン類似体の経腟および筋肉内投与後に、稀に深刻な心血管障害 欧州連合
プロストール
(心筋梗塞及び/又は冠状動脈の痙攣並びに重度の低血圧)が、報
告されている」等の投与経路に関する記載を削除し、「高用量のプロ
スタグランジン類似体の使用後、稀に深刻な心血管障害(心筋梗塞
及び/又は冠状動脈の痙攣並びに重度の低血圧)が報告されてい
る」等への改訂
その他
対応不要
欧州PRACは、ミソプロストール(適応:人工妊娠中絶)のPeriodic
safety update reports(PSURs)において、ミソプロストールを含む製
ミフェプリストン・ミソ 品の製品情報を改訂する必要があるとのCMDhの結論が出された
349
欧州連合
プロストール
旨を公表した。主な改訂内容は以下のとおり。
Special warnings and precautions for use及びUndesirable effectsに
心停止を追記する
その他
注目
350 イトラコナゾール
内用液の米国添付文書が改訂され、Boxed warningの心不全及び
心臓への影響の項の記載が以下の通り変更された。
旧:カプセルの投与中にうっ血性心不全の徴候や症状が現れた場
アメリカ
合は、投与を中止してください。
新:内用液の投与中にうっ血性心不全の徴候又は症状が現れた場
合は、本剤の継続使用を再検討する必要があります。
その他
対応不要
ドルゾラミド塩酸塩・
チモロールマレイン
351 酸塩
チモロールマレイン
酸塩
ドイツBfArMが以下の情報を掲載した。
・欧州CHMPは、生物学的同等性試験を実施した特定CROのGCP
不適合に伴い、複数のジェネリック医薬品にたいして販売承認一時
停止の勧告を決定した。関連する医薬品リストにチモロール錠が含 ドイツ
まれていた。
・今後、欧州委員会に送られ、欧州委員会はすべてのEU加盟国で
法的拘束力のある最終決定を下す予定である。
その他
対応不要
その他
対応済
347
アメリカ
米国FDAはピタバスタチンの米国添付文書を改訂した。主な内容は
以下のとおり。
ピタバスタチンカル ・Adverse ReactionsのPostmarketing experienceの項に、眼筋無力
352
アメリカ
シウム
症を含む重症筋無力症の新規発症または増悪がまれに報告されて
おり、同じスタチンまたは異なるスタチンを投与した場合に再発が報
告されている旨を追記する。
54