よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.4MB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
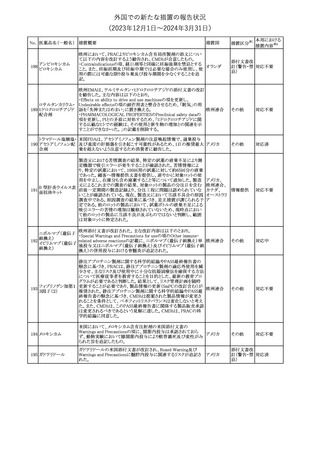
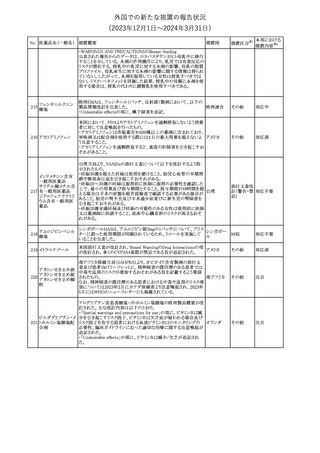
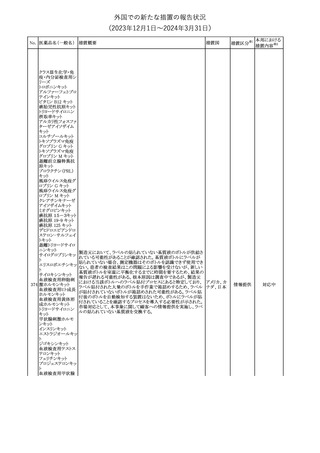
外国での新たな措置の報告状況
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
【第1報】
英MHRAは、2024年1月の経口バルプロ酸の安全対策について以
下の措置が含まれる予定であると公表した。
・他に効果的または許容可能な治療法がないこと、又は生殖リスクが
適用されないやむを得ない理由があることを2人の専門家が独立し
て検討し文書化しない限り、55歳未満の新規患者(男性又は女性)
に対してバルプロ酸の投与を開始してはならない。
・次回の年次専門家レビューでは、妊娠可能な女性と女児は、改訂
20 バルプロ酸ナトリウム されたvalproate Risk Acknowledgement Formを使用してレビューさ イギリス
れる必要がある。これには患者がバルプロ酸の投与を継続し、患者
の状況が変わらない限りその後も1人の専門医による年次レビューを
継続する場合、2人目の専門医の署名が必要になる。
【第2報】
英国では、妊娠中にバルプロ酸を服用した場合の児へのリスクや男
性への生殖能力障害リスク等をふまえ、2024年1月より55歳未満の
男性及び女性における規制措置がなされている。今般、英MHRAは
教育資料をHPに公表した。
その他
対応中
【第1報】【第2報】
米 FDAは、クロバザムの製品情報及び投薬ガイドに好酸球増加と
アメリカ
全身症状を伴う薬物反応(DRESS)のリスクに関する警告を追加する
よう勧告した。
その他
注目
仏国添付文書について、以下の点が改訂された。
①Posology and method of administrationの項の「選択的動脈内カ
テーテル治療のみ。」を「選択的血管内カテーテル治療のみ。」に改
訂。
ヨード化ケシ油脂肪 ②Special warnings and precautions for useの項の「静脈内投与、動
22
フランス
酸エチルエステル 脈内投与(選択的カテーテル治療は除く)、髄腔内投与で投与して
はならない。」を「全身性血管内投与または髄腔内投与してはならな
い。」に改訂。
③Undesirabl effectsの項の「肺炎(pneumonite)」を「びまん性間質性
肺炎(pneumopathie interstitielle diffuse)」に改訂。
その他
対応不要
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
・Special Warnings and Precautions for use及びFertility, pregnancy
L-アスパラギナー and lactationの項において、「治療中及び治療中止後、男性は少な
23
オランダ
ゼ
くとも3カ月間、妊娠可能な女性は7カ月間は有効な避妊法を用いる
こと」の記載が「妊娠可能な女性は治療中および治療終了後7カ月
間は有効な避妊法を用いること」に変更された。
その他
注目
CCDSが改訂された。主な改訂内容は以下のとおり。
・Special warnings and precautions for useの項に、無菌性髄膜炎を ベルギー
追記。
その他
対応済
欧州CMDhは、オメガ-3酸エチルエステルの添付文書に心房細動
のリスクを追記するPRAC勧告を支持した。主な内容は以下のとお
り。
イコサペント酸エチ ・Special warnings and precautions for useの項に、ランダム化比較
ル
臨床試験のシステマティックレビュー及びメタアナリシスでは、確立し
25
欧州連合
オメガ-3脂肪酸エ た心血管疾患又は心血管リスク因子を有する患者にオメガ-3酸エ
チル
チルエステルを投与した場合、プラセボと比較して心房細動のリスク
が用量依存的に増加する。観察されたリスクは1日4gの投与で最も
高くなる旨を追記する。
・Undesirable effectsの項に、心房細動を追記する。
その他
注目
第22回 Summary Monthly Safety Report (SMSR)(報告期間:2023
年10月1日~2023年10月31日)を入手したもの。報告期間中、安全
ニルマトレルビル・リ
性懸念リストに変更はなかった。また第20回SMSRの報告期間中に アメリカ
26
トナビル
開始された、出血性下痢症の安全性シグナルは否定され評価終了
となった。
その他
対応不要
その他
注目
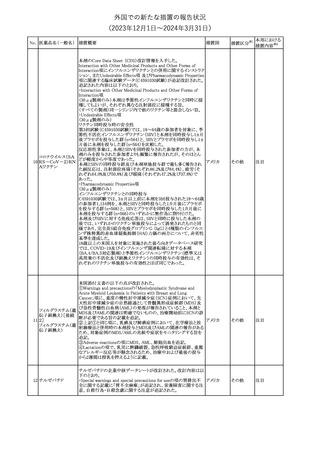
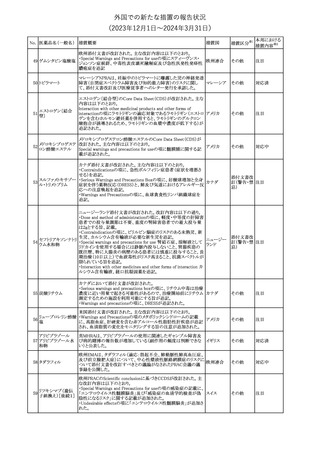
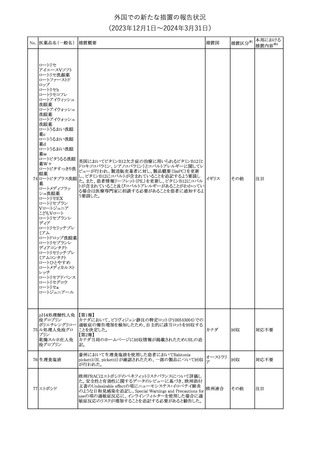
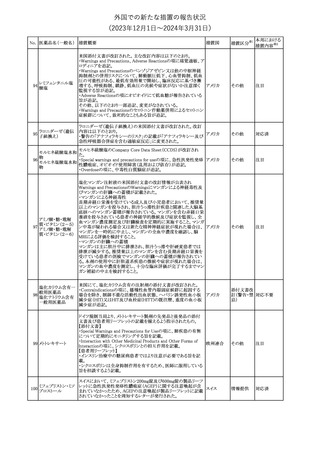
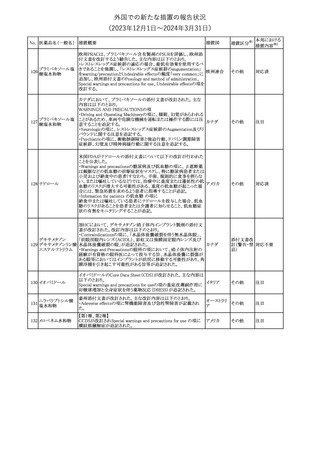
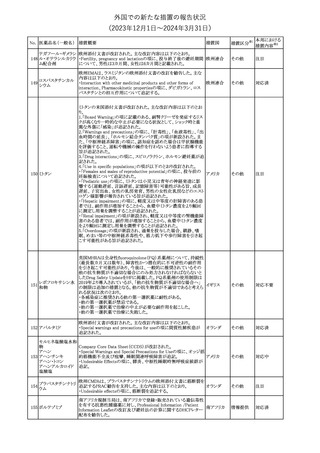
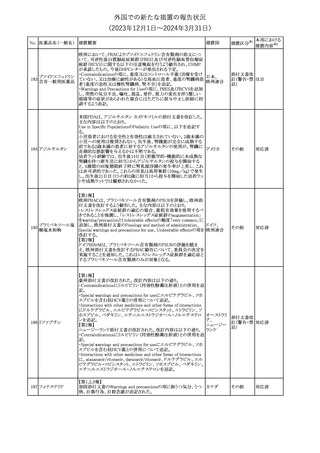
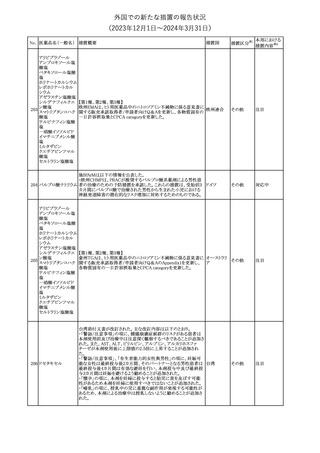
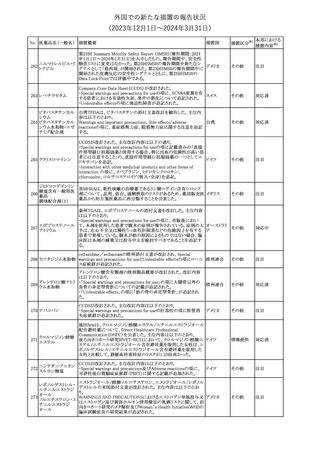
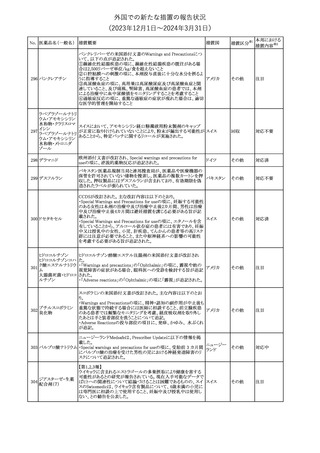
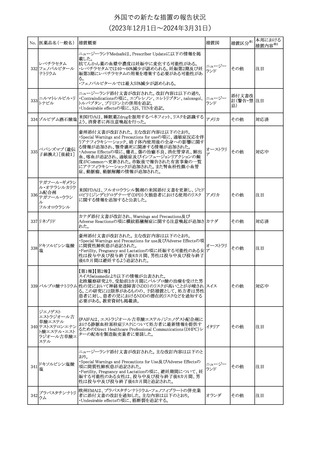
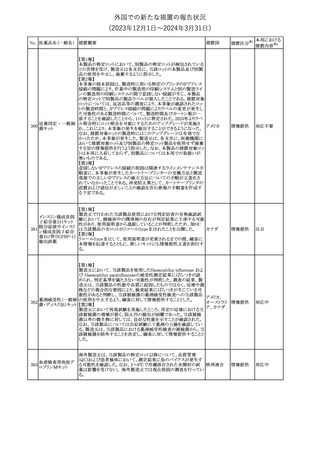
No. 医薬品名(一般名) 措置概要
21 クロバザム
24
ロザノリキシズマブ
(遺伝子組換え)
27 プレガバリン
措置国
欧州PRACは、プレガバリンのPSURを評価し、離脱症状の一部とし
て自殺念慮を含めるように製品情報の更新を勧告した。
欧州連合
豪TGAは、シタグリプチン製品について、ニトロソアミンの一つである
NTTP(7-Nitroso-3-(trifluoromethyl)-5,6,7,8-tetrahydro[1,2,4]
シタグリプチンリン酸
オーストラリ
28
triazolo-[4,3-a]pyrazine)の許容摂取量の限度(37ng/day)を超える
その他
塩水和物
ア
製品の供給を許可する移行期間を2024年6月末まで延長することを
公表した。
5
対応済
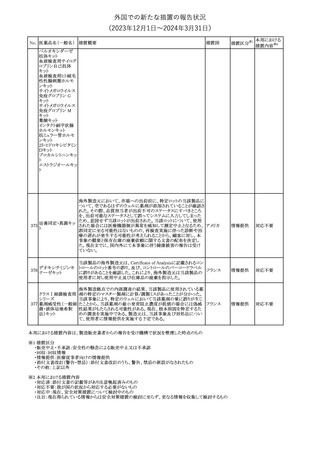
(2023年12⽉1⽇〜2024年3⽉31⽇)
措置区分※1
本邦における
措置内容※2
【第1報】
英MHRAは、2024年1月の経口バルプロ酸の安全対策について以
下の措置が含まれる予定であると公表した。
・他に効果的または許容可能な治療法がないこと、又は生殖リスクが
適用されないやむを得ない理由があることを2人の専門家が独立し
て検討し文書化しない限り、55歳未満の新規患者(男性又は女性)
に対してバルプロ酸の投与を開始してはならない。
・次回の年次専門家レビューでは、妊娠可能な女性と女児は、改訂
20 バルプロ酸ナトリウム されたvalproate Risk Acknowledgement Formを使用してレビューさ イギリス
れる必要がある。これには患者がバルプロ酸の投与を継続し、患者
の状況が変わらない限りその後も1人の専門医による年次レビューを
継続する場合、2人目の専門医の署名が必要になる。
【第2報】
英国では、妊娠中にバルプロ酸を服用した場合の児へのリスクや男
性への生殖能力障害リスク等をふまえ、2024年1月より55歳未満の
男性及び女性における規制措置がなされている。今般、英MHRAは
教育資料をHPに公表した。
その他
対応中
【第1報】【第2報】
米 FDAは、クロバザムの製品情報及び投薬ガイドに好酸球増加と
アメリカ
全身症状を伴う薬物反応(DRESS)のリスクに関する警告を追加する
よう勧告した。
その他
注目
仏国添付文書について、以下の点が改訂された。
①Posology and method of administrationの項の「選択的動脈内カ
テーテル治療のみ。」を「選択的血管内カテーテル治療のみ。」に改
訂。
ヨード化ケシ油脂肪 ②Special warnings and precautions for useの項の「静脈内投与、動
22
フランス
酸エチルエステル 脈内投与(選択的カテーテル治療は除く)、髄腔内投与で投与して
はならない。」を「全身性血管内投与または髄腔内投与してはならな
い。」に改訂。
③Undesirabl effectsの項の「肺炎(pneumonite)」を「びまん性間質性
肺炎(pneumopathie interstitielle diffuse)」に改訂。
その他
対応不要
欧州添付文書が改訂された。主な改訂内容は以下のとおり。
・Special Warnings and Precautions for use及びFertility, pregnancy
L-アスパラギナー and lactationの項において、「治療中及び治療中止後、男性は少な
23
オランダ
ゼ
くとも3カ月間、妊娠可能な女性は7カ月間は有効な避妊法を用いる
こと」の記載が「妊娠可能な女性は治療中および治療終了後7カ月
間は有効な避妊法を用いること」に変更された。
その他
注目
CCDSが改訂された。主な改訂内容は以下のとおり。
・Special warnings and precautions for useの項に、無菌性髄膜炎を ベルギー
追記。
その他
対応済
欧州CMDhは、オメガ-3酸エチルエステルの添付文書に心房細動
のリスクを追記するPRAC勧告を支持した。主な内容は以下のとお
り。
イコサペント酸エチ ・Special warnings and precautions for useの項に、ランダム化比較
ル
臨床試験のシステマティックレビュー及びメタアナリシスでは、確立し
25
欧州連合
オメガ-3脂肪酸エ た心血管疾患又は心血管リスク因子を有する患者にオメガ-3酸エ
チル
チルエステルを投与した場合、プラセボと比較して心房細動のリスク
が用量依存的に増加する。観察されたリスクは1日4gの投与で最も
高くなる旨を追記する。
・Undesirable effectsの項に、心房細動を追記する。
その他
注目
第22回 Summary Monthly Safety Report (SMSR)(報告期間:2023
年10月1日~2023年10月31日)を入手したもの。報告期間中、安全
ニルマトレルビル・リ
性懸念リストに変更はなかった。また第20回SMSRの報告期間中に アメリカ
26
トナビル
開始された、出血性下痢症の安全性シグナルは否定され評価終了
となった。
その他
対応不要
その他
注目
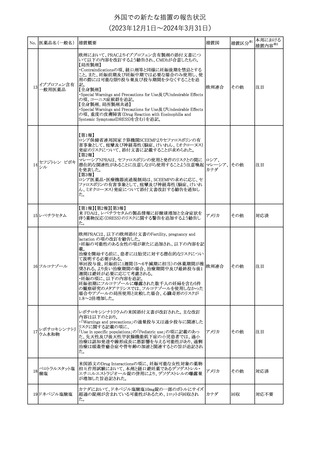
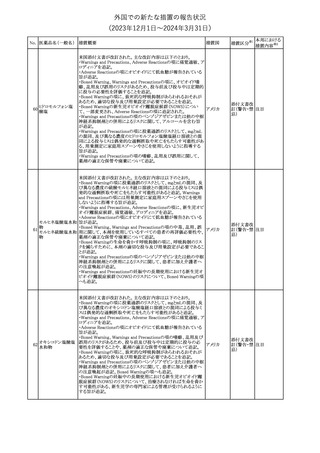
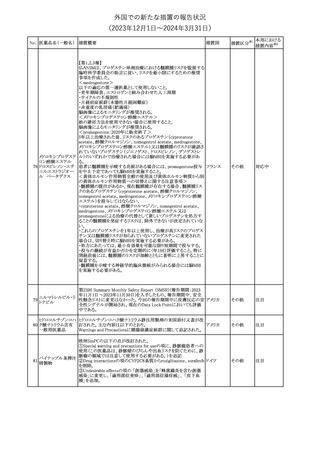
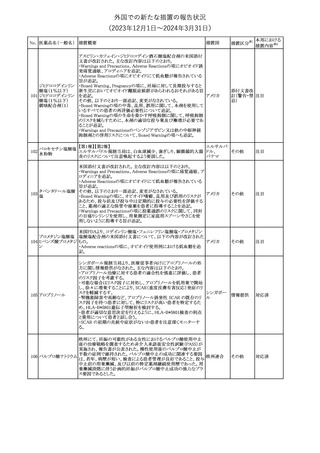
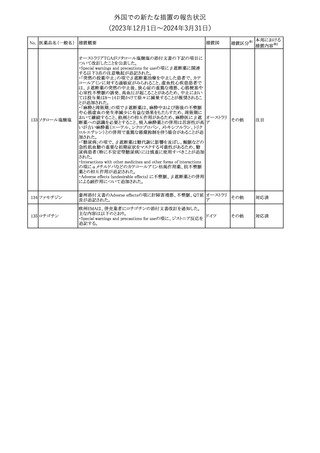
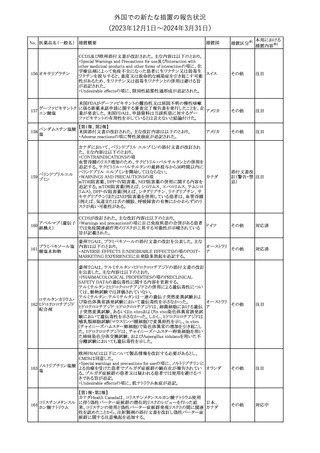
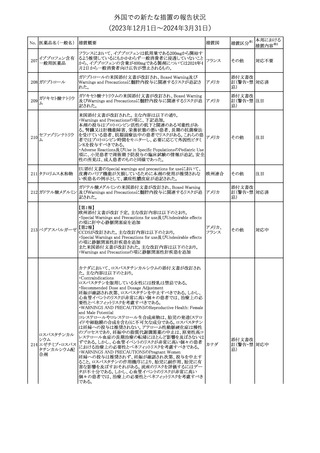
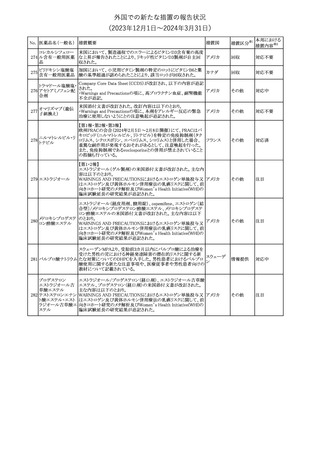
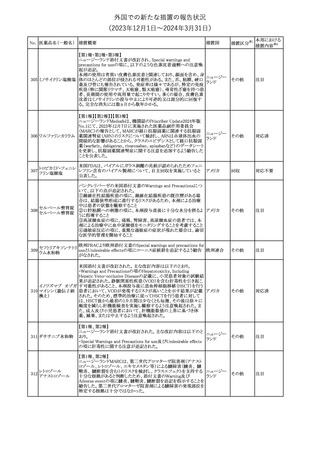
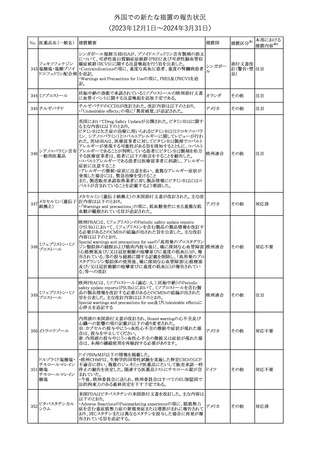
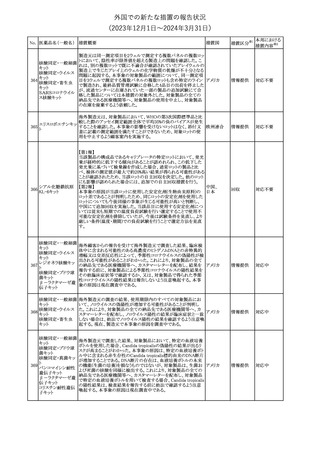
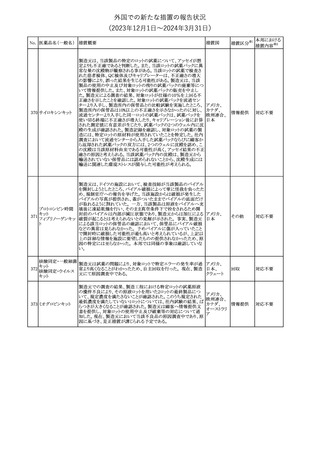
No. 医薬品名(一般名) 措置概要
21 クロバザム
24
ロザノリキシズマブ
(遺伝子組換え)
27 プレガバリン
措置国
欧州PRACは、プレガバリンのPSURを評価し、離脱症状の一部とし
て自殺念慮を含めるように製品情報の更新を勧告した。
欧州連合
豪TGAは、シタグリプチン製品について、ニトロソアミンの一つである
NTTP(7-Nitroso-3-(trifluoromethyl)-5,6,7,8-tetrahydro[1,2,4]
シタグリプチンリン酸
オーストラリ
28
triazolo-[4,3-a]pyrazine)の許容摂取量の限度(37ng/day)を超える
その他
塩水和物
ア
製品の供給を許可する移行期間を2024年6月末まで延長することを
公表した。
5
対応済