よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
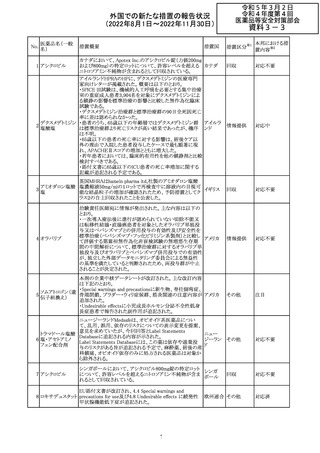
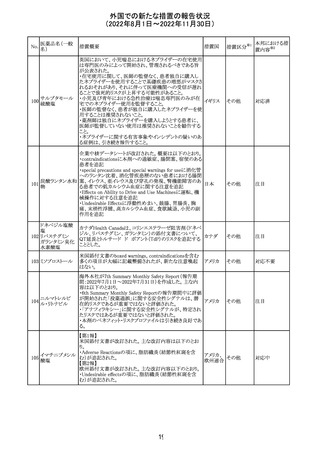
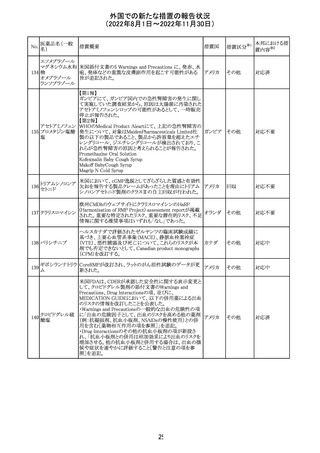
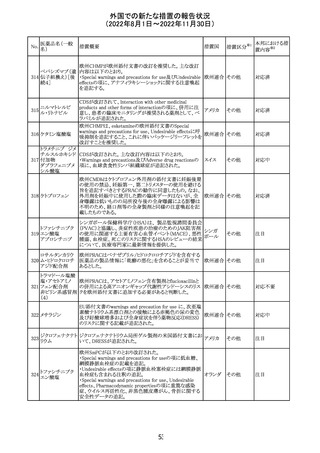
外国での新たな措置の報告状況
(2022年8月1日~2022年11月30日)
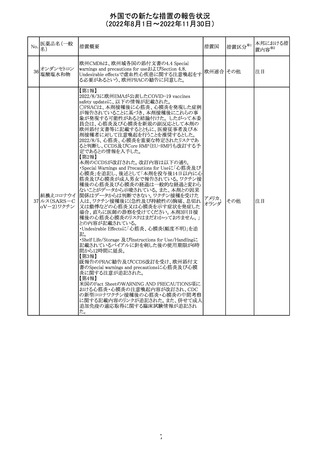
No.
医薬品名(一般
名)
措置概要
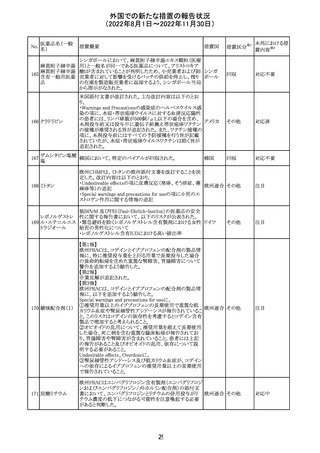
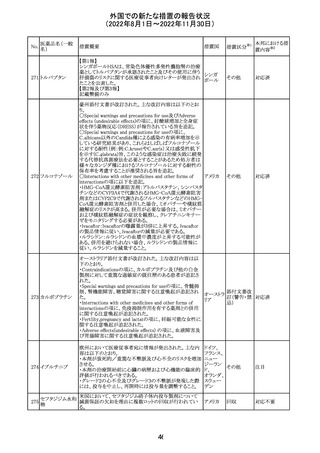
措置国
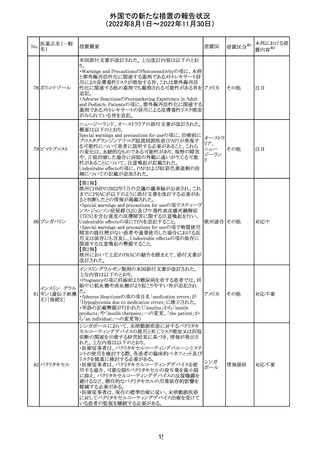
加国添付文書が改訂された。主な改訂箇所は以下のとお
り。
・Dosage and administrationの項およびWarnings and
precautionsのPregnant womenの項にこれまでに得られてい
るデータより、単剤で使用した場合でも本剤が投与された
母より出生した児において大奇形および神経発達障害のリ
スクが増大することが示唆されていることが記載された。
・Warnings and precautionsの重篤な肝障害の項に投与開
始から最初の6カ月は特に頻度高く肝機能検査をする必要
があること、患者の既往歴等は十分に考慮する必要がある
こと。また、2歳以下の小児に投与する場合には、特に注意
深く観察する必要があり、単剤で使用し、肝障害リスクのた
めサリチル酸系薬との併用はしないことが記載された。
・Warnings and precautionsの項に行動障害の項が追加さ
バルプロ酸ナトリ
88
れ、攻撃性、激越、異常行動、精神行動亢進、注意力障 カナダ
ウム
害、学習障害等を含む行動障害があらわれることがあるこ
と、投与量による発現傾向の違いは明らかになっていない
こと、本剤が投与された母より出生した児において注意欠
陥/多動性障害(AD/HD)、自閉症スペクトラム障害、発育
遅延が報告されていることが注意喚起された。
・Warnings and precautionsのFertilityの項に無月経、多嚢
胞性卵巣、テストステロン値上昇が報告されていること精巣
の発達に対する影響は明らかではなく、精液の質の低下や
男性不妊が生じる可能性があること等が注意喚起された。
・Warnings and precautionsのPregnant womenの項に他の
適切な治療法がない限りは本剤を使用しないこと、大奇形
が報告されていること、妊娠可能な女性に対して投与する
場合には胎児における危険性を説明する必要があること等
が注意喚起された。
措置区分※1
本邦における措
置内容※2
その他
対応中
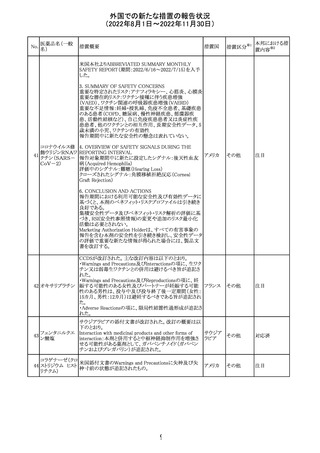
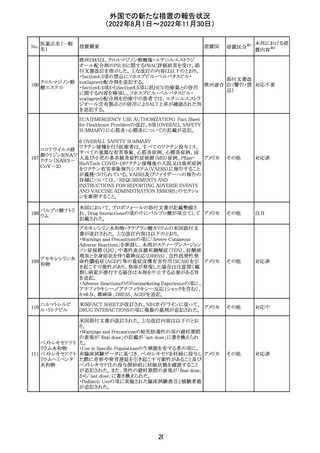
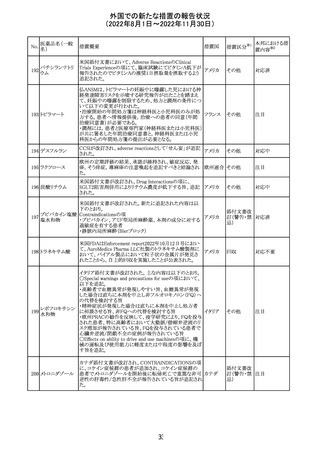
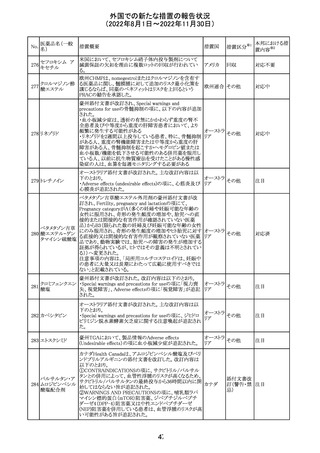
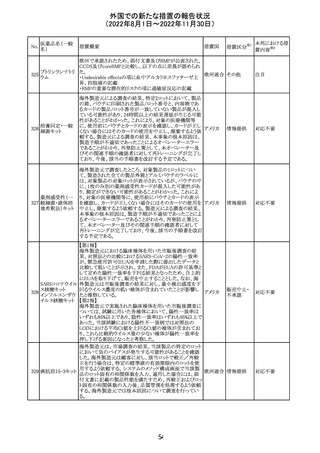
豪TGAは、海外企業のフルデオキシグルコース(18F)の特
定ロットについて、無菌試験で微生物が検出されたことから
フルデオキシグル
オーストラ
89
クラスⅠのリコールアクションがとられた。放射性医薬品の
回収
コース(18F)
リア
特性上、製剤は無菌試験が完了する前にすでに使用され
ていた。
90
イリノテカン塩酸
塩水和物
91 アザシチジン
対応不要
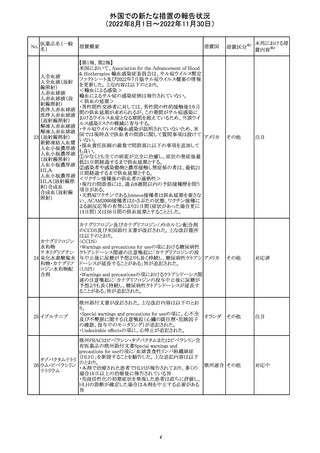
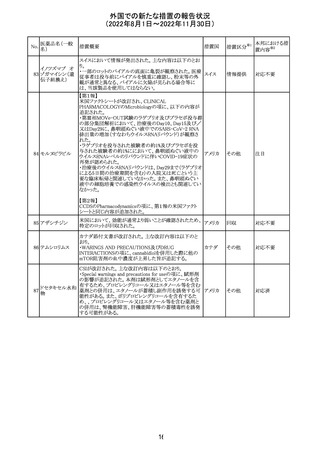
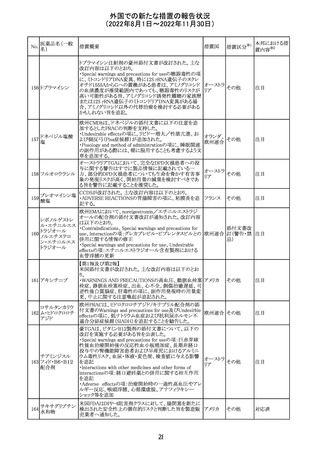
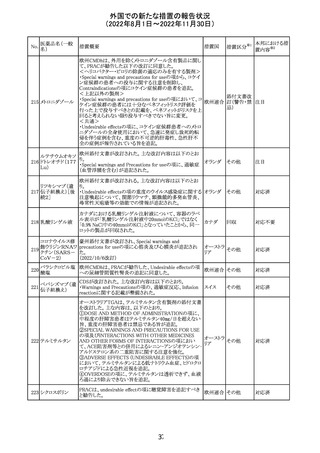
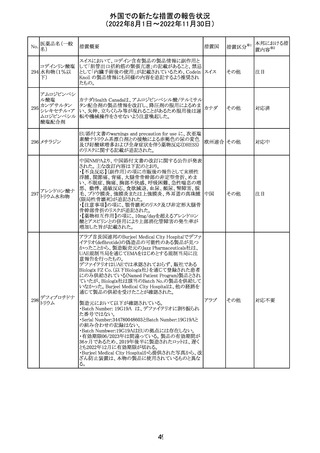
欧州CHMPが欧州添付文書の改訂に合意した。主な改訂
内容は以下のとおり。
・Special warnings and precautions for use及びUndesirable
effectsの項に、過敏症反応に関する注意喚起へ用語を追
記する。
・Interaction with other medicinal products and other forms
of interactionの項に、フルシトシンとの相互作用の追記す
欧州連合 その他
る。
・Fertility, pregnancy and lactationの項に、妊娠する可能
性のある女性の避妊期間の修正及び配偶子の保存に関す
る記載を追記する。
・Special precautions for disposal and other handlingの項
に、投与前の輸液の調製時に使用される針のサイズに関
する説明の追記する。
注目
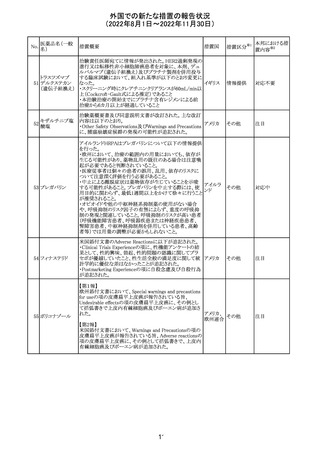
米国において、安定性規格に不適合が認められたため、
特定のロットが回収された。
対応不要
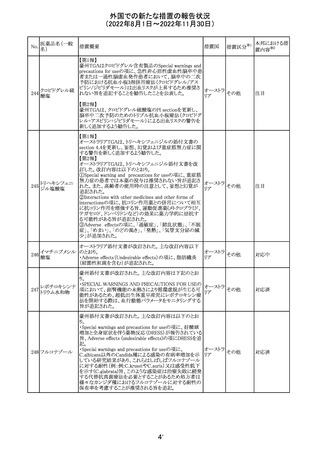
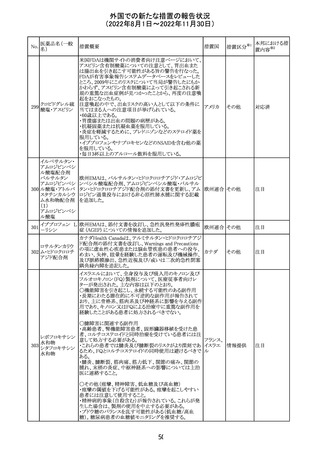
ロサルタンカリウ オーストラリアTGAはキナプリル製品の供給の一時停止を
92 ム・ヒドロクロロチ 公表した。また、許容できないレベルのN-ニトロソキナプリ
アジド
ルを含むことが確認された一部製品を回収している。
17
アメリカ
回収
オーストラ
回収
リア
注目
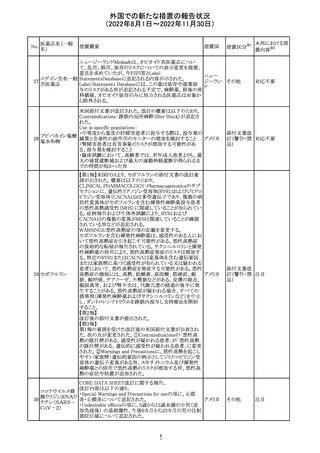
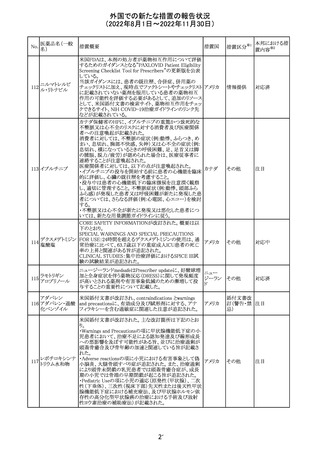
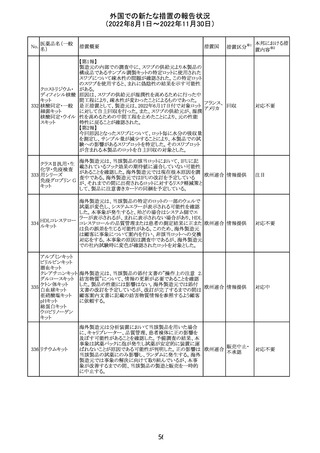
(2022年8月1日~2022年11月30日)
No.
医薬品名(一般
名)
措置概要
措置国
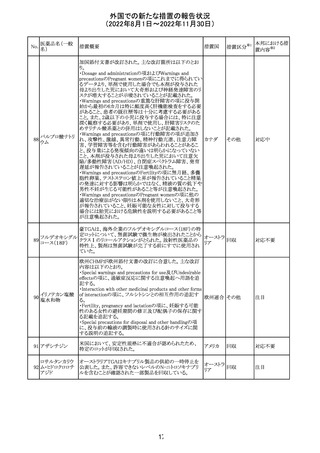
加国添付文書が改訂された。主な改訂箇所は以下のとお
り。
・Dosage and administrationの項およびWarnings and
precautionsのPregnant womenの項にこれまでに得られてい
るデータより、単剤で使用した場合でも本剤が投与された
母より出生した児において大奇形および神経発達障害のリ
スクが増大することが示唆されていることが記載された。
・Warnings and precautionsの重篤な肝障害の項に投与開
始から最初の6カ月は特に頻度高く肝機能検査をする必要
があること、患者の既往歴等は十分に考慮する必要がある
こと。また、2歳以下の小児に投与する場合には、特に注意
深く観察する必要があり、単剤で使用し、肝障害リスクのた
めサリチル酸系薬との併用はしないことが記載された。
・Warnings and precautionsの項に行動障害の項が追加さ
バルプロ酸ナトリ
88
れ、攻撃性、激越、異常行動、精神行動亢進、注意力障 カナダ
ウム
害、学習障害等を含む行動障害があらわれることがあるこ
と、投与量による発現傾向の違いは明らかになっていない
こと、本剤が投与された母より出生した児において注意欠
陥/多動性障害(AD/HD)、自閉症スペクトラム障害、発育
遅延が報告されていることが注意喚起された。
・Warnings and precautionsのFertilityの項に無月経、多嚢
胞性卵巣、テストステロン値上昇が報告されていること精巣
の発達に対する影響は明らかではなく、精液の質の低下や
男性不妊が生じる可能性があること等が注意喚起された。
・Warnings and precautionsのPregnant womenの項に他の
適切な治療法がない限りは本剤を使用しないこと、大奇形
が報告されていること、妊娠可能な女性に対して投与する
場合には胎児における危険性を説明する必要があること等
が注意喚起された。
措置区分※1
本邦における措
置内容※2
その他
対応中
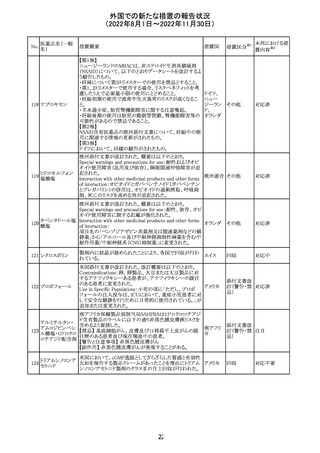
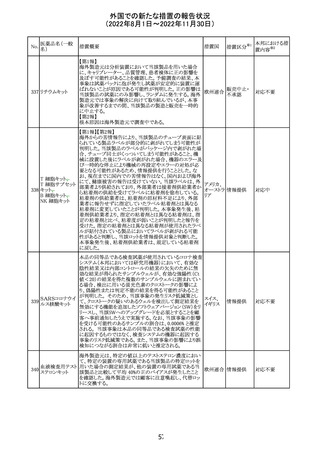
豪TGAは、海外企業のフルデオキシグルコース(18F)の特
定ロットについて、無菌試験で微生物が検出されたことから
フルデオキシグル
オーストラ
89
クラスⅠのリコールアクションがとられた。放射性医薬品の
回収
コース(18F)
リア
特性上、製剤は無菌試験が完了する前にすでに使用され
ていた。
90
イリノテカン塩酸
塩水和物
91 アザシチジン
対応不要
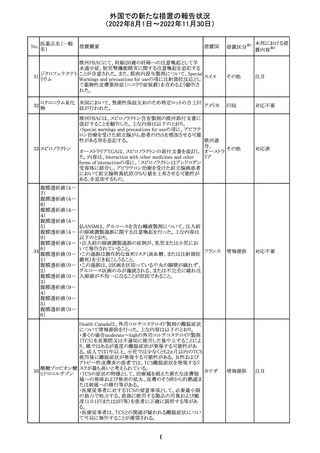
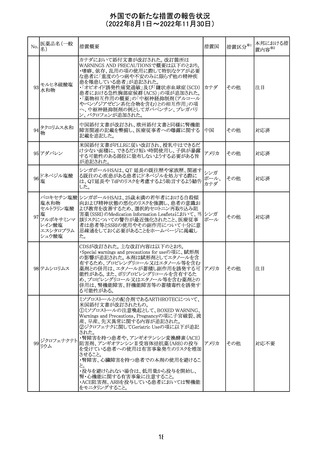
欧州CHMPが欧州添付文書の改訂に合意した。主な改訂
内容は以下のとおり。
・Special warnings and precautions for use及びUndesirable
effectsの項に、過敏症反応に関する注意喚起へ用語を追
記する。
・Interaction with other medicinal products and other forms
of interactionの項に、フルシトシンとの相互作用の追記す
欧州連合 その他
る。
・Fertility, pregnancy and lactationの項に、妊娠する可能
性のある女性の避妊期間の修正及び配偶子の保存に関す
る記載を追記する。
・Special precautions for disposal and other handlingの項
に、投与前の輸液の調製時に使用される針のサイズに関
する説明の追記する。
注目
米国において、安定性規格に不適合が認められたため、
特定のロットが回収された。
対応不要
ロサルタンカリウ オーストラリアTGAはキナプリル製品の供給の一時停止を
92 ム・ヒドロクロロチ 公表した。また、許容できないレベルのN-ニトロソキナプリ
アジド
ルを含むことが確認された一部製品を回収している。
17
アメリカ
回収
オーストラ
回収
リア
注目